Nrf2 Teil 2: Was aktiviert es? und warum sind Nrf2-Blockaden, Endotoxine und chronische Entzündungen für das „Detox“ so kritisch?
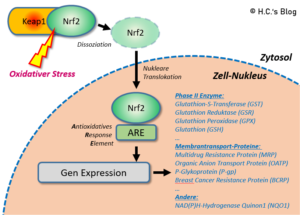
Oxidativer Stress führt dazu, dass Nrf2 vom Bindungsprotein (Keap1) im Zytosol dissoziiert und in den Kern verlagert wird, wo es die Promotorregion (ARE) bindet, was zur Transkription von Entgiftungsenzymen und Proteinen führt.
In diesem zweiten Teil zu NRF2 möchte ich das Fortsetzen, was ich im ersten Teil angefangen hatte. Anbei noch einmal die Einleitung vom ersten Teil: Nrf2 ist die Abkürzung für Nuklearer Faktor Erythroid 2-verwandter Faktor (Engl.: Nuclear factor erythroid 2-related factor) und ist der zentrale Transkriptionsfaktor für die antioxidativen Signalwege und damit der ‚zelluläre Schalter‘ für die körpereigenen Detox-Systeme.
Was bedeutet das in Kürze? Bei oxidativem Stress wird der Nrf2-Transkriptionsfaktor (-> ein Protein) freigesetzt, welcher dafür sorgt, das bestimmte Teile der DNA abgelesen und vervielfältigt werden. Im Falle von Nrf2 werden viele antioxidative Enzyme gefördert, die u.a. mit Glutathion-Systemen und der Phase II, aber auch der Phase III der biochemischen Entgiftung zusammenhängen. Ohne die ‚hoch-Regulierung‘ von Nrf2 (-> Gaspedal) dümpelt dann auch die körpereigene Entgiftung vor sich her.
In diesem Artikel möchte ich betrachten, was dieses im Falle einer Blockade von Nrf2 bedeuten kann und wie Nrf2 dennoch aktiviert werden könnte, wenn es so etwas wie eine Blockade, die u.a. Shade thematisiert, existiert.
- Was ist so kritisch an einer Nrf2-Blockade bzw. Endotoxinen und chronischen Entzündungen?
- Was fördert (aktiviert) & moduliert Nrf2? – Toxine (u.a. Arsen), Chlor, Sport, Polyphenole, Isothiocyanate, Schwefelverbindungen & Co.
- Gibt es auch ein ‚zuviel‘ oder ‚zu lange‘ der Aktivierung von Nrf2? Meint: Negative Auswirkungen & Rückkopplung
Am Artikelende folgt dann mein übliches Fazit. Hier noch die direkten Links auf die Folgeartikel:
- Teil 1: Der zentrale Schalter für die ‘Hoch-Regulation’ der antioxidativen Systeme und der biochemischen Entgiftung (Detox Phase II & III, Glutathion-Systeme & Membran-Transporter)
- Teil 3: (Pflanzliche) Substanzen zur Modulierung von Nrf2: Eine Übersicht + ‘Wumms’-Faktor & Seiteneffekte
- Teil 4: Pflanzliche Substanzen zur Modulierung von Nrf2: DIM / I3C, Sulforaphan / Brokkoli, Haritaki (aus Triphala)
- Teil 5: Pflanzliche Aktivatoren im Check: Quercitin, EGCG, ALA, Pterostilbene & Resveratrol, Curcumin & mehr zu DJ-1
Inhaltsverzeichnis für den Schnellzugriff
Was ist so kritisch an einer Nrf2-Blockade bzw. Endotoxinen und chronischen Entzündungen?
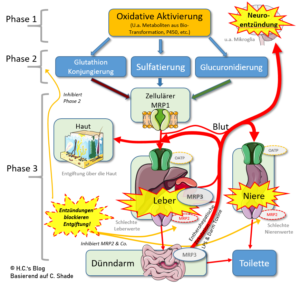
Krankhafter Zustand: Gastrointestinale Entzündung und erhöhte intestinale Permeabilität ermöglichen die Freisetzung von Endotoxin (LPS) aus Bakterien im Darm in den Kreislauf. Endotoxin und verwandte Entzündungszytokine blockieren die Entgiftungswege, indem sie die Entgiftungsenzyme und Phase III-Transporter herunterregulieren und zur Cholestase und Nierenschädigung beitragen.
Das Problem ist, das bei einer Blockade bzw. Supprimierung von Nrf2 die Phasen II & III der Entgiftung gebremst werden, aber die Phase I (-> Biotransformation) fröhlich ‚weiter macht‘ und es so zu einem konstanten Aufbau eines Pools an (hoch-) toxischen Metaboliten aus Phase I kommt, der durch die Phase II nicht schnell genug weiterverarbeitet werden kann [21]. Wer also ‚Entgiftet‘ und dabei krasse Nebenwirkungen (-> ‚Brain Fog‘ & Co.) verspürt – der macht meist was falsch, weil dieses in der Regel Symptome einer Vergiftung sind, was oft auf eine Blockade der Phase II und / oder II hindeutet. Shade erklärt dann auch einen Teil des Teufelskreislauf speziell in Bezug auf die Endotoxine [26]:
Was fördert (aktiviert) & moduliert Nrf2? – Toxine (u.a. Arsen), Chlor, Sport, Polyphenole, Isothiocyanate, Schwefelverbindungen & Co.
Grundsätzlich alles was oxidativen Stress macht – speziell insbesondere viele Toxine, mit Ausnahme der vorgenannten. So weist Shade [2][27] immer wieder auf folgende Abfolge hin:
„Oxidativer Stress -> NRF2 -> Anti-Oxidantien-Antwort“
Oxidativen Stress gibt es oft ungewollt ‚Gratis‘:
- Chlor [10] bzw. viele Chlor-Derivate (-> 2MMS, CDS/CDL?),
- wie z.B. Dioxin (umgangssprachlich), also 2,3,7,8-Tetrachlordibenzodioxin – eine chlorhaltige, hochgiftige organische Verbindung. [15]
- Arsenit und andere Arsenverbindungen [15],
- eine verringerte zelluläre antioxidative Kapazität [2],
- die Exposition gegenüber toxischen Substanzen wie Luftverschmutzung und Schwermetallen [2] und
- viel Chemikalien und Arzneimittel [34]
Wer jetzt denkt, das ein bisschen Dioxin oder Arsen ggf. eine ‚gute‘ Idee wäre – dem mag ich mitteilen, das eine übermäßige (-> pathophysiologische) Nrf2-Aktivität von Dioxin zu Chlorakne führen kann, und ähnliches auch bei Arsen zu beobachten ist. [15] Im Positiven können folgende Dinge Nrf2 induzieren [15][26]:
- Lebensstilfaktoren wie Entspannung, Atemtechniken und Bewegung [2]
- Fasten [12], IR-Sauna, Finnische Sauna, Sonne (IR, UV), Kälte [34]
- Viele polyphenolische Substanzen bzw. ‚Antioxidantien‘ – aber nicht alle
- z.B. Grüntee-Extrakt, Granatapfel-Extrakt, Kiefernrindenextrakt, Haritaki, etc.
- Isothiocyanate aus kreuzblütigen Lebensmitteln
- z.B. in Brokkoli und Kohlgewächsen,
- hier speziell Sulforaphan (Brokkoli), I3C, DIM (als wirksamen Metaboliten des Sulforaphan).
- Triterpenoide und andere Terpene (als Hauptbestandteil der in Pflanzen produzierten ätherischen Öle)
- z.B. Apfel, Pfefferminz, Oregano, Thymian
- Schwefelverbindungen einschließlich Allylsulfide
- z.B. Knoblauch/Zwiebeln/Allium-Lebensmitteln und der Brokkoli-Familie,
- aber bitte keinen desodorierten Knoblauch, denn es ist der ‚Gestank des Knoblauchs‘, der wirkt (-> Knoblauchöl). [18]
- Zudem die Alpha-Liponsäure – welche u.a. der Liebling von Shade (Quicksilver Scientific) ist [2][18] – wobei ich hier Vorsicht walten lassen würde!
- Viele Carotinoide,
- wobei Lycopin offenbar am aktivsten ist und
- Astaxanthin mit DHA/EPA synergistisch wirkt.
- γ-, δ-Tocopherole und Tocotrienole (Vitamin E-Formen)
- α-Tocopherol hat wohl eher wenig Aktivität
- Fischöl (langkettige Omega-3-Fettsäuren DHA und EPA)
- Ray Peat geht ja davon aus, das dieses ggf. durch oxidierte O3-Supplemente passiert, und die Studien hier mir Vorsicht zu genießen sind.
- Mäßiger oxidativer Stress (Sport, Hormesis)
- Anm: Bewegung, wirkt zum Teil über mäßigen oxidativen Stress; kann auch in der Vaskulatur über laminaren Scherstress wirken
- Aber auch Substanzen wie NMN (Vitamin B3-Form) [11] und Probiotika [34]
Ganz spannend ist, das die meisten dieser Substanzen als Antioxidanten angepriesen werden, aber eigentlich Pro-Oxidantien sind. Viele diätetische Antioxidantien deaktivieren also reaktive Sauerstoff-Spezies (ROS) & Co. nicht, indem sie direkt mit ihnen reagieren, sondern aktivieren (über oxidativen Stress) das Keap1-Nrf2-ARE-Signalsystem, das die Expression vieler (vorgenannter) Antioxidans- und Entgiftungsgene steuert. [1]
Martin Pall folgert so, das phytochemisch reichhaltige Ernährungsformen wie die traditionelle mediterrane Ernährung und die traditionelle okinawische Ernährung eine Nrf2-Expression fördern. So ist anzunehmen, das gerade Obst und Gemüse nicht unbedingt (nur) über Vitamine & Mineralien wirken – sondern auch über die Stimulation des Nrf2 Signalwegs.
Shade merkt an [2][27], das um NRF2 zu aktivieren, ein Schwellenwert einer oxidativen Reaktion (d. h. Entzündung) erreicht werden muss, damit der Körper eine adaptive (antioxidative) Reaktion auslöst. Dieser Schwellwert-anstieg sollte ’schnell und hart‘ erfolgen – wozu Shade seine liposomalen Supplemente einsetzt. Alternativ eine (ausreichend) hohe Dosis eines entsprechenden Stoffes (z.B. Polyphenol) auf nüchternen Magen. Dies macht für mich Sinn, weil Nrf2 eine Halbwertszeit (unter basalen Bedingungen) von ca. 20 Min [13] hat. Wird nur ‚langsam gestresst‘ (-> Chronisch latenter Stress) – dann verbleibt das Niveau von Nrf2 ggf. auch auf geringem Level. Dies ist wohl so, weil NRF2 schnell arbeitet, um das Redox-Signal (das Gleichgewicht von Oxidationsmittel- und Antioxidationsmittelwerten in einer Zelle) auszugleichen [27].
Ein hoch-reguliertes Nrf2 verbessert dann die Reaktion des Körpers auf Medikamente und Toxine, indem es die auch die (schon weiter oben angesprochenen) Multidrug Resistance-Associated Proteins (MRPs, Proteine, die dabei helfen, Chemikalien aus der Zelle zu verdrängen) erhöht [22].
Gibt es auch ein ‚zuviel‘ oder ‚zu lange‘ der Aktivierung von Nrf2? Meint: Negative Auswirkungen & Rückkopplung
Die Antwort ist wohl: Ja!
Der österreichische Arzt Dr. Retzek [32] merkt an, das er bei Krebspatienten auf Nrf2-Aktivierung verzichtet und dort auf exogen zugeführten Bindemittel setzt. Dies wohl, weil es in Bezug auf die Nrf2-Aktivierung und Krebs widersprüchliches zu lesen gibt. So gibt es wohl auch eine negative Seite von Nrf2: Wenn es überaktiviert wird, kann es ggf. Herz-Kreislauf-Erkrankungen und Krebs mit Multiresistenz verursachen [1] und wohl den insulinähnlichen Wachstumsfaktor 1 (IGF-1) in der Leber blockieren. Letzterer ist aber für die Regeneration der Leber notwendig [34]. Aber auch das nicht nicht alles – im Falle, das Nrf2 chronisch über-aktiviert wird, lässt die Wirkung auf die antioxidativen (-> Phase II) und zumindest hepatischen Systeme (-> Phase III) wohl recht schnell nach [7].
Forschungen an Drosophila (Taufliegen) [47] zeigten, das eine milde Nrf2-Aktivierung die Lebensspanne verlängert, jedoch hohe Nrf2-Expressionsniveaus zu Entwicklungsletalität, veränderter mitochondrialer Bioenergetik, dem Auftreten von Diabetes-Typ-1 und beschleunigter Alterung. Deswegen sind wohl die zytoprotektiven Stresssensoren (z.B. Nrf2, Foxo, p53, etc.) kurzlebige Proteine und es erklärt auch die eingebauten negativen Rückkopplungsschleifen für Nrf2, wie gleich noch weiter vertieft.
So schreibt auch Pall [15], das eine chronische Nrf2-Stimulation auf hohem Niveau pathophysiologische Reaktionen im Körper hervorruft und das vielleicht beste dokumentierte Beispiel hierfür die chronische Erhöhung der Nrf2-Spiegel durch TCDD (Dioxin) ist, welche zu Chlorakne führt. So sein nach Pall allgemein anerkannt:
„dass eine konstante hohe Nrf2-Aktivität viel wahrscheinlicher schädlich ist als eine variable Aktivierung.“
Man kann sich das als Analogie so vorstellen wie bei sportlicher Betätigung. Der Sport selbst produziert eher Schäden im Körper, der Benefit liegt in der Regenerationsphase, da durch Überkompensation mehr repariert wird als kaputt war. Setzt man aber zu viele intensive Trainingsreize kurz hintereinander, kommt man ins Übertraining…
Hinweis: Der nächste kurze Abschnitt zur vorgenannten Studie [7] ist nur für eingeloggte Unterstützer sichtbar.
Mein Fazit
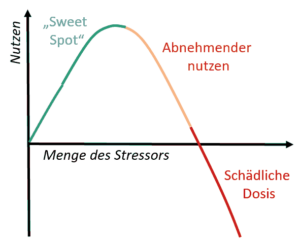
Das Konzept der Hormese visualisiert. Bild: H.C.
Wie wichtig eine (hormetische) Aktivierung von Nrf2 ist, wird aus meiner Sicht klar, wenn ich auf die Liste der Inhibitoren schaue. Menschen die einmal über Monte und Jahre mit Hausschimmel in Berührung gekommen sind – haben auch nach der Sanierung oft viele chronifizierte Probleme. Aus meiner Sicht spricht dieses für die von Shade angesprochene epigenetische Blockade von Nrf2. Welche anderen Toxine diese ggf. erzeugen – wer weiß. In jedem Fall kann auch ein chronisch entzündeter Darm (-> Endotoxine) in Verbindung mit Quecksilber (aus Amalgam) über die aktive Blockade von Nrf2 wirken – was heutzutage sicherlich viele Menschen betrifft.
Um wirklich zu untersuchen was ‚ab geht‘ müsste man alle 5-10 Minuten die Expression der Detox-Enzyme messen. Wenn sich in Folge einer Stress-Reaktion (z.B. ALA) Nrf2 innerhalb von Minuten von Keap1 löst und an ARE bindet – dann sollten sich die Ergebnisse, Enzymabhängig, schnell zeigen. Warum ist mir das so wichtig? Hier noch mal die Zusammenfassung:
- Nrf2 hat eine kurze Halbwertzeit (<30 min), wobei das ganze Nrf2-Abhängige System
- über ARE wohl bis zu 10 Tage ‚hochmoduliert‘ werden kann – bevor es zu einem negativen Feedback kommt.
- Ein hoher und schneller „Peak“ (Anflutung im Serum/Plasma) ist wichtig um Nrf2 von Keap1 zu lösen,
- ein leerer Magen und optional eine liposomale Zubereitung sind die Schlüssel dafür.
- Eine Pulsung von Nrf2-Aktivatoren scheint relevant: z.B. 5-10 Tage ‚on‘, 3-5 Tage ‚off‘.
Die verbleibende Frage ist nun für viele sicher: Wie kann ich Nrf2 effektiv modulieren? Solch eine Frage untergliedert sich dann aus meiner Sicht in: a) welche Stoffe könnten dafür genutzt werden bzw. sind potentiell effektiv, b) welche Dosierungen könnten richtig sein und c) wie, wann und in welchen Mustern (z.B. Intermittierend) sollten diese dann zugeführt werden. Genau dies sind dann die Fragen für die nächsten Teile dieser Serie.
Links / Quellen
- [1] The Role of the Nrf2/ARE Antioxidant System in Preventing Cardiovascular Diseases, Robert E. Smith, et al., Diseases. 2016 Dec; 4(4): 34., doi: 10.3390/diseases4040034
- [2] A Push-Catch System That Enables Effective Detoxification, Christopher Shade, PhD, and Carrie Decker, ND, Townsend Newsletter, February / March 2018 (Referenzen, Grafiken, Auf einer Seite)
- [3] 5 Ways to Activate the Anti-oxidant Benefits of Nrf2, Dr. Jockers
- [4] Ep 145 – Advanced Detoxification Protocols for Heavy Metals, Leaky Gut, Lyme Disease, and Chronic EBV with Dr. Chris Shade, Biohacking Sectrets Show,
- [5] Lipoic Acid, Linus Pauling Institute (LPI)
- [6] Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential, Kate Petersen Shay et al., Biochim Biophys Acta. 2009 Oct; 1790(10): 1149–1160., Published online 2009 Aug 4. doi: 10.1016/j.bbagen.2009.07.026
- [7] St. John’s Wort (Hypericum perforatum) induces overexpression of multidrug resistance protein 2 (MRP2) in rats: a 30-day ingestion study, Y Shibayama et al., Food Chem Toxicol, 2004 Jun;42(6):995-1002., doi: 10.1016/j.fct.2004.02.012.
- [8] Death by Calcium, Dr. T. Levy, MedFox Publishing, 2013
- [9] Oxidative and electrophilic stress induces multidrug resistance-associated protein transporters via the nuclear factor-E2-related factor-2 transcriptional pathway, Jonathan M Maher et al., Hepatology, 2007 Nov;46(5):1597-610. doi: 10.1002/hep.21831.
- [10] Innovative drinking water treatment techniques reduce the disinfection-induced oxidative stress and genotoxic activity, Johan Lundqvist et al., Water Res, 2019 May 15;155:182-192. doi: 10.1016/j.watres.2019.02.052. Epub 2019 Feb 28.
- [11] Nicotinamide mononucleotide attenuates brain injury after intracerebral hemorrhage by activating Nrf2/HO-1 signaling pathway, Chun-Chun Wei et al.,Sci Rep. 2017; 7: 717., Published online 2017 Apr 6. doi: 10.1038/s41598-017-00851-z
- [12] Fasting Induces Nuclear Factor E2-Related Factor 2 and ATP-Binding Cassette Transporters via Protein Kinase A and Sirtuin-1 in Mouse and Human, Supriya R. Kulkarni et al., Antioxid Redox Signal. 2014 Jan 1; 20(1): 15–30., doi: 10.1089/ars.2012.5082
- [13] Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2, Akira Kobayashi et al., Mol Cell Biol, 2004 Aug;24(16):7130-9. doi: 10.1128/MCB.24.16.7130-7139.2004.
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare