Alpha-Liponsäure (ALA) Teil 1: Allgemeines, Antioxidanz (-> Nrf2, Redoxpartner), Metal-Chelator (ggf. Quecksilber), R- und S-Form, Bioverfügbarkeit, Interaktionen & Nebenwirkungen
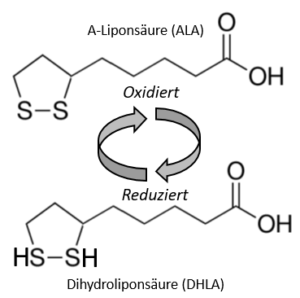
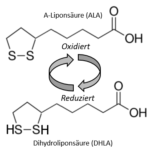
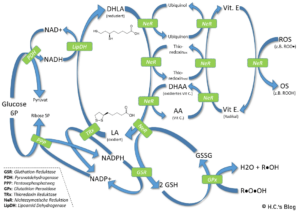
Redoxpaar aus ALA (oxidiert) und DHLA (reduziert).
Mit dieser zweiteiligen Artikel-Serie zum Thema Alpha-Liponsäure (ALA) möchte ich die bereits vorhandenen Beiträge im Blog – speziell zu potentiellen Seiteneffekten bei vorliegender Belastung mit Quecksilber (u.a. aus Amalgam) – ergänzen. Zur Thematik ALA, Quecksilber, A. Hall Cutler & C. Shade gibt es dann noch 3 Extra-Artikel.
Aber nun zu ALA: Grundsätzlich ist ALA eine geniale Substanz – und es gibt viele Studien, welche alle möglichen positiven Effekte von ALA beschreiben: ALA ist ein direktes Antioxidanz und reduziert (recycelt) Vitamin C, Q10, Vitamin E. Als DHLA (-> Dihydroliponsäure, reduziertes ALA) kann es unseren wichtigsten physiologischen Chelator Glutathion (GSH) [3] aus oxidiertem GSH (GSSG) recyceln [10][11].
ALA ist auch ein sehr potenter Nrf2-Stimulator und regelt damit die antioxidativen Systeme hoch [4][12] – recycelt also nicht nur GSH & Co, sondern fördert noch dessen Produktion. Weiterhin ist ALA bzw. das DHLA wohl auch ein Chelator verschiedener Schwer- und Übergangsmetallen (u.a. Fe3+, Cu2+,Zn2+, Cd2+ und wohl auch organischem und anorganischem Quecksilber -> Hg2+) [4][9][10][11][31][44][62]. Was das alles in Konsequenz bedeutet – genau das möchte ich in dieser Serie betrachten. Was ist nun mein Fokus im Teil 1 dieser Serie zu ALA?
- Übersicht der verschiedenen Rollen & (Aus-) Wirkungen von ALA und DHLA im Körper
- Das Redoxpaar aus ALA (oxidiert) und DHLA (reduziert)
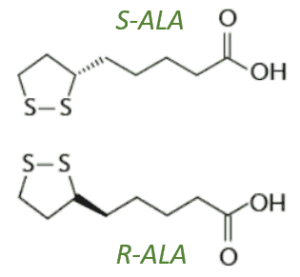
- Zur R-, S- und RS-Alpha Liponsäure
- Vorkommen von Alpha-Liponsäure in der Nahrung
- Die antioxidative Seite von ALA & DHLA – direkt und als Reduktionsmittel (indirekt)
- Die antioxidative Seite von ALA: Nrf2 und die indirekte Wirkung auf Glutathion und die antioxidativen Systeme
- ALA & DHLA: Direkte Chelatoren von Schwer- und Übergangsmetallen
- ALA & DHLA: Direkte Chelatoren von Quecksilber (Hg)?
- Zellgängigkeit von ALA/DHLA, der NAD+ (NADH/NADPH) Metabolismus und Glutathion
- Pharmakokinetik – Bioverfügbarkeit & Absorption von ALA
- Interaktionen von ALA (Biotin, Vitamin B5)
- Sicherheit & Nebenwirkungen von ALA
- Warum vertragen manche Menschen 600-1200 mg ALA trotz Amalgam-Vergangenheit ‘problemlos’?
Am Ende des Artikels folgt dann wie üblich mein Fazit.
In den weiteren Teilen möchte ich dann folgenden Aspekten nachgehen:
- Teil 2: Halbwertszeiten von R-ALA, Na-R-ALA und RS-ALA im Plasma & Hinweise von Cutler zur Verwendung bei der Quecksilber-Ausleitung
- Teil 3: Ist ALA ein effektiver intrazellulärer Quecksilber-Chelator oder nicht? Cutler und / oder Shade?
- Teil 4: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Die Zerlegung der wichtigsten Studien: Gregus, Leskova, Grunert, Chekmeneva, Hossain und Bjørklund
- Teil 5: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Cutler vs. Shade – die Perspektive von R. Rust Lee und mein Fazit
Sehr viel Lesestoff – ich weiß. Die Thematik ist jedoch so komplex, das Sie letztendlich kaum jemand begreift – falls das auf Basis der uns vorliegenden Daten überhaupt möglich ist. Doch zu letzterem mehr in Teil 3-5 dieser Serie.
Inhaltsverzeichnis für den Schnellzugriff
Übersicht der verschiedenen Rollen & (Aus-) Wirkungen von ALA und DHLA im Körper
Alpha-Liposäure, auch α-Liponsäure geschrieben, Liponsäure oder Thioctsäure genannt, ist eine natürlich in Pflanzen und Tieren vorkommende organische Schwefelverbindung, die im begrenzten Maßstab auch vom Menschen in den Mitochondrien synthetisiert wird [16].
(R-)ALA und DHLA haben dann verschiedenste Rollen im Körper und sind u.a. [2][4][14][16][23][58][62][63]:
- als Antioxidanten fungieren u.a. gegeben reaktive Sauerstoffspezies (ROS),
- wobei sie als lipid- (Fett-) als auch als wasserlösliche Verbindung reagieren und ist in Zellmembranen, Cytosol und extrazellulären Räumen weit verbreitet [53],
- so leicht die Blut-Gehirn-Schranke (BHS) überwinden und Zell-Membranen passieren, was sie von anderen Antioxidantien stark unterscheidet, und
- dort nachweislich die Lipidperoxidation im Gehirn– und Ischias-Nervengewebe (in Ratten) verringert.
- DHLA regeneriert andere Antioxidantien (u.a. Vitamin C, E, Q10 und Glutathion),
- R-ALA wirkt indirekt über Nrf2 auf die antioxidativen Systeme und reguliert diese hoch (-> als Pro-Oxidant) – nicht jedoch die S-Form [23],
- erhöht die intra- als auch den extrazellulären Glutathionspiegel, u.a. in T-Zell-Kulturen, menschlichen Erythrozyten, Gliazellen und Lymphozyten des peripheren Blutes,
- kehrt (nur als R-ALA) die altersassoziierte Erhöhung der Anfälligkeit von Hepatozyten gegenüber tert-Butylhydroperoxid (auch in Vivo) um [23],
- fungieren auch als direkter Chelator von (übergangs-) Metallen, u.a. Hg2+ (letzteres nur DHLA),
- steuern zu verschiedenen chemischen Reaktionen in Citrat-Zyklus bei,
- fungieren (in den R-Varianten) als Cofaktor für einige Enzymkomplexe, die an der Energiegewinnung der Zelle (Mitochondrien) beteiligt sind, u.a. [32]
- das Glycinspaltungssystem zur Synthetisierung von 5,10-Methylentetrahydrofolat, einem wichtigen Kofaktor bei der Synthese von Nukleinsäuren
- Der Pyruvat-Dehydrogenase-Komplex, der die Umwandlung von Pyruvat in Acetyl-Coenzym A (CoA) katalysiert (-> Substrat für den Citrat-Zyklus)
- Der α-Ketoglutarat-Dehydrogenase-Komplex, der die Umwandlung von α-Ketoglutarat in Succinyl-CoA katalysiert (-> Substrat für den Citrat-Zyklus)
- Der verzweigtkettige α-Ketosäure-Dehydrogenase-Komplex (-> Decarboxylierung von Ketosäuren im katabolen Weg, im Kontext Leucin, Isoleucin und Valin)
- Der 2-Oxoadipat-Dehydrogenase-Komplex (-> Decarboxylierung von 2-Oxoadipat im katabolen Weg, im Kontext Lysin, Hydroxylysin und Tryptophan).
- sind somit also am Glukose- und Lipidstoffwechsel beteiligt,
- verbessert (nur als R-ALA) die Insulinsignalisierung durch PI3K/Akt über erhöhte Phosphorylierung des Insulinrezeptors und IRS-1 [23],
- steuern die Gentranskription,
- wirken anti-inflammatorisch (hemmen NF-kB, CAM1, Zytokine, iNOS),
- aktivieren AMPK,
- hemmen die Histon-Deacetylase, erhöhen indirekt die Telomerlänge durch Induktion von PCG-1a
- wirkt Neuroprotektiv [49] u.a. da es GSH verbessere, was nur schlecht verabreicht werden kann [55],
- verhinderte als DHLA die Hg2+-verursachte intrinsische Apoptose in PC12-Zellen über die Hemmung der Hg-Akkumulation,
- die Verbesserung der GSH-Reduktase, die Hemmung der GSH-Oxidation, die Reparatur der DNA-Degradation,
- die Hemmung der LDH-Entladung und die Begrenzung der Cytochrom-c-Leckage aus den Mitochondrien [62]
- und viel mehr…
Zu den genauen Details und anderen Interaktionen gibt es dann tausende von Studien und viele dicke Bücher. Da ich mich hier auf die Rolle von ALA und DHLA als Antioxidanz und Metall-Chelator fokussieren möchte, versuche ich mich nicht zu stark in die allgemeinen Details zu vertiefen.
Zum Redoxpaar aus ALA (oxidiert) und DHLA (reduziert)
Die Liponsäure enthält zwei Thiol- (Schwefel-) Gruppen, die oxidiert oder reduziert sein können, kommt also als sogenanntes Redox-Paar vor, meint [32]:
- Oxidiert als Alpha-Liponsäure, ALA (-> 1,2-Dithiolan-3-Pentansäure bzw. C8H14O2S2) [53] und
- Reduziert als Dihydroliponsäure, DHLA
Dabei wird ALA u.a. über verschiedene NAD+-Zyklen im Zytosol bzw. den Mitochondrien zu DHLA reduziert. So zeigen Studien, dass ALA schnell zu DHLA reduziert wird, das dann ebenso schnell aus den Zellen ausgeschieden wird [12]. DHLA dient dann für viele andere Prozesse als Reduktionsmittel (-> Reduktionspotential von -0,32 V) und wird nach Abgabe seiner Elektronen wieder zu ALA. Das Bild an Anfang dieses Artikel verdeutlicht diesen Mechanismus – wie auch das Bild im nächsten Abschnitt.
Zur R-, S- und RS-Alpha Liponsäure
ALA enthält auch einen sogenannten asymmetrischen Kohlenstoff, was bedeutet, dass Liponsäure als eines von zwei Möglichen optischen Isomeren, auch Enantiomere genannt, vorliegen kann. Was das genau bedeutet hatte ich schon mal in meinem Artikel zu Folat (Teil 2) beschrieben. Diese Enantiomere sind Spiegelbilder voneinander, wobei die:
- R-Liponsäure, die natürlich Form ist, welche in Nahrungsmitteln vorkommt und endogen synthetisiert wird und die
- S-Liponsäure der (chemischen) Synthese von (RS-) ALA entsteht – nie natürlich.
ALA in Nahrungsergänzungsmitteln liegt entweder nur als R-Liponsäure (R-ALA, teuer) oder als ein sogenannten ‘racemisches’ 50:50 Gemisch aus R-Liponsäure und S-Liponsäure vor (RS-ALA, günstig) [32]. Im Körper werden R- und S-Form unterschiedlich metabolisiert, wobei nur die R-Form enzymatisch aktiv werden kann und die S-Form teils als ‘Ballast’ bezeichnet wird [10][23] und wichtige Aktivitäten von R-ALA stoppen bzw. reduzieren soll, z. B. ihre Interaktion mit Genen, Enzymen und Proteinen [16]. So kann die S-Liponsäure als Inhibitor der Lipoamid-Dehydrogenase (LipDH, mehr dazu weiter unten im Text) wirken (in Verweis auf Biewenga et al., 1996a), was aber bei sättigenden NADH-Konzentrationen (über 0,1 mM) nicht relevant war, so das die R-DHLA-Bildung durch S-Liponsäure in den Mitochondrien nicht beeinflusst war [10].
Nach Verabreichung von RS-Alpha Liponsäure koexistieren R-DHLA und S-Liponsäure im gleichen Zellkompartiment, wobei es zu nicht-enzymatischen Reduktion des einen Isomers durch die reduzierte Form des anderen, so kann S-DHLA die R-Liponsäure nicht enzymatisch reduzieren. Bei Applikation von RS-ALA an neugeborene Ratten produzierte diese Form dann mehr DHLA in den Augenlinsen als die R-Liponsäure oder S-Liponsäure allein. Gleichzeitig zeigte RS-ALA einen stärkeren Schutz vor Buthioninsulfoximin (BSO)-induziertem Katarakt als die reinen Isomere [10], wobei die Wirkung auf R-ALA beruht [63]. Grundsätzlich haben aber mehrere Studien gezeigt, dass S-ALA die spezifischen Effekte von R-ALA durch kompetitive Hemmung beeinträchtigt [33], wobei es natürlich auch die beschriebenen positiven Effekte zu geben scheint [34].
Was bei Studien, welche die (Blut-) Plasmawerte von R-ALA, bei oraler Gabe von R-ALA (300 mg) im Vergleich zu RS-ALA (600 mg) ermittelten [20] noch auffällig war, ist, dass der Anstieg von R-ALA im (Blut-) Plasma bei der Gabe von RS-ALA nicht so stark anstieg, dafür aber länger dauerte. Bei der Gabe von reinem R-ALA, ist der ‘Peak’ höher – der Abfall der Kurve jedoch auch – die Fläche unter der Kurve jedoch ähnlich. So spricht für mich einiges dafür, das das S-Eantiomer den Stoffwechsel von RS-ALA bzw. den Abbau bzw. die Metabolisierung von R-ALA bremst.
Grundsätzlich sind die meisten (klinischen) Studien mit RS-ALA durchgeführt worden. Allerdings liegt es für mich nahe, das nur ‘R-ALA’ auf bestimmte biochemische Prozesse im Körper anders wirkt als RS-ALA, u.a. in Bezug auf die Induktion von Nrf2 – ein Thema, was ich später in diesem Artikel noch vertiefe.
Mein Zwischenfazit ist so: Das teure R-ALA ist also nicht pauschal ‘besser’ als das günstige RS-ALA – und umgekehrt.
Vorkommen von Alpha-Liponsäure in der Nahrung
Die endogene Synthese soll nicht ausreichen um den (Energie-)bedarf der Zelle zu decken, so das ALA meist über die Nahrung, insbesondere über Fleisch und Gemüse, aber auch Obst, aufgenommen wird. Pflanzliche und tierische Gewebe enthalten geringe Mengen an R-LA, die in Form von Lipoyllysin (Bindung von LA an spezifische Lysinreste) nachgewiesen werden. Die häufigsten
- pflanzlichen Quellen von R-LA sind Spinat, Brokkoli und Tomaten, die jeweils 3,2, 0,9 und 0,6 mg Lipoyllysin/g Trockenmasse enthalten. In
- tierischen Geweben wird die höchste Konzentration von Lipoyllysin in Niere, Herz und Leber gefunden, die jeweils 2,6, 1,5 und 0,9 mg Lipoyllysin/g Trockenmasse enthalten. [58]
Bei den Mengenangaben ist zu beachten, das es sich hier um Komplexe handelt – die nur wenige ‘Milligramm’ an ALA enthalten. So hat der Verzehr von Liponsäure aus der Nahrung bisher noch nicht zu nachweisbaren Erhöhungen der freien Liponsäure im menschlichen Plasma oder in den Zellen geführt [58].
Die antioxidative Seite von ALA & DHLA – direkt und als Reduktionsmittel (indirekt)
ALA wird oft als wichtiges ‘Antioxidanz’ vermarktet bzw. beworben. Die Frage mag sein, was überhaupt ein ‘Antioxidanz’ auszeichnet. Rochette et al. [58] nennen folgende Qualitäten:
- Spezifität der Radikalfängeraktivität;
- metallchelatbildende Aktivität;
- Interaktion mit anderen Antioxidantien;
- Konzentration im intrazellulären Kompartiment und in der extrazellulären Flüssigkeit; und
- Induktion von Proteinen, die am antioxidativen Schutz beteiligt sind.
Einige dieser Qualitäten sind direkt andere indirekt, wobei ALA (bzw. DHLA) zwar direkte antixoxidative Qualitäten haben (1), jedoch eher indirekt antioxidativ wirken und um dies zu erzielen sogar pro-oxidativ sind, auch wenn das erst einmal paradox klingen mag. Das gesamte Wirkspektrum von ALA kategorisiere ich dann folgend [10]
- direkt (Peroxynitrit, Hydroxil Radikal, etc.,
- indirekt-direkt, als Reduktionsmittel und
- indirekt, hier speziell über die Keap/Nrf2-Induzierte Hochregulation der antioxidativen (u.a. Glutathion-) Systeme der Phase II & III der biochemischen Entgiftung, geschehen kann.
Aber alles von Anfang an: In Bezug auf die ‘indirekt-direkt ‘ antioxidative Wirkung von DHLA als Reduktionsmittel mit der es andere Antioxidantien, z.B. Vitamin C, E, Q10, recyceln kann – wie im nebenstehenden Bild zu sehen. Weiterhin wird DHLA in vielen enzymatischen Prozessen als Reduktionsmittel benötigt. Hier eine kurze Übersicht [3][4][10]:
- Nichtenzymatische Regeneration von (verbrauchten) antioxidantien Vitamin E, Vitamin C, Q10 und Glutathion.
- So kann DHLA sowohl den intra- als auch den extrazellulären Glutathionspiegel in T-Zell-Kulturen, menschlichen Erythrozyten, Gliazellen und peripheren Blutlymphozyten erhöhen. [3]
- DHLA + GSSG (oxidiertes Glutathion) —> ALA + 2 GSH
- DHLA + DHAA (oxidiertes Vitamin C) —> ALA + Vitamin C (Ascorbinsäure)
- Versorgung der Peptid-Methioninsulfoxid-Reduktase (MsrA) mit reduzierenden Äquivalenten versorgen. Die MsrA katalysiert die Reduktion von Methioninsulfoxid in Proteinen zurück zu Methionin, fördert so die Reparatur von oxidativ geschädigten Proteinen wie z. B. α-1-Antiprotease und wirkt dadurch antixodativ bzw. protektiv.
- Durch die Lipoamid-Dehydrogenase (LipDH) abhängige Reduktion von ALA zu DHLA kann die Zelle, zusätzlich zu ihrem NADPH-Pool (der normalerweise bei oxidativem Stress verbraucht wird), auf ihren NADH-Pool für die antioxidative Aktivität zurückgreifen.
Das Reduktionspotential von -0,32 V macht DHLA zu einem der potentesten natürlich vorkommenden Antioxidantien [12]. ALA und DHLA wirken in vielen Fällen (direkt) antioxidativ, wobei DHLA insgesamt mehr antioxidative Eigenschaften als Liponsäure aufweist.
In Bezug auf die direkte Wirkung von ALA/DHLA als Antioxidanz gibt es viele Hinweise darauf, dass sowohl LA als auch DHLA in der Lage sind, eine Vielzahl von reaktiven Sauerstoffspezies zu neutralisieren, ohne dabei selbst eines zu werden. So können sowohl ALA als auch DHLA Hydroxylradikale und hypochlorige Säure abfangen, während ALA auch Singulett-Sauerstoff abfängt. Allerding sind viele Nachweise nur aus der Petrischale (In-vitro-Beweise) und es bleibt wohl fraglich, ob ALA/DHLA auch freie Radikale in vivo (im Menschen) effektiv abfangen können und wie große die Rolle von ALA/DHLA dort im Vergleich zu anderen Mechanismen ist. Hier noch eine Tabelle zu den potentiellen antioxidativen Fähigkeiten [12]:
| Oxidant | Gescavenged durch ALA? Ratenkonstante |
Gescavenged durch DHLA? Ratenkonstante |
|---|---|---|
| Peroxynitrit (ONOO) | Ja, 1.4 × 103 M-1 s-1 | Ja, 2.5 × 102 M-1 s-1 |
| Stickstoffmonoxid (•NO) | Nein | Ja, 3.19 M-1 s-1 |
| Hydroxyl Radikal (HOCl) | Ja, 4.7 × 1010 M-1 s-1 Nein |
Nein Ja |
| Superoxid (O2•-) | Nein | Nein Ja, 3.3 × 105 M-1 s-1 Ja |
| Singulett-Sauerstoff | Ja, 1.3 × 108 M-1 s-1 Ja |
Nein |
| Peroxyl Radikal | Ja, 1.8 × 108 M-1 s-1 Nein |
Ja, 2.3 × 107 M-1 s-1 Ja |
| Hypochlorsäure | Ja | Ja |
| Wasserstoff-Peroxid (H2O2) | Nein | Nein |
Anmerkung: Wenn da Ja & Nein steht – dann sagt eine Studie Ja – und eine andere Nein.
Allerdings haben beide wahrscheinlich keinen großen direkten Einfluss auf den Redox-Status durch Abfangen von Radikalen aufgrund ihrer vorübergehenden Anwesenheit (nach Smith et al 2004). So muss jegliches (theoretisches) therapeutisches Potenzial von DHLA mit seiner kurzen Halbwertszeit aufgrund der schnellen Bis-Methylierung in Einklang gebracht werden.[23], weswegen ich selber den Effekt als Co-Faktor (-> Reduktionsmittel) und Nrf2-Inducer (nachfolgend beschrieben) für die wichtigsten Aspekte von ALA/DHLA halte.
Die antioxidative Seite von ALA: Nrf2 und die indirekte Wirkung auf Glutathion und die antioxidativen Systeme
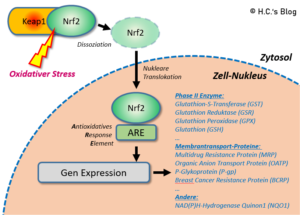
Oxidativer Stress führt dazu, dass Nrf2 vom Bindungsprotein (Keap1) im Zytosol dissoziiert und in den Kern verlagert wird, wo es die Promotorregion (ARE) bindet, was zur Transkription von Entgiftungsenzymen und Proteinen führt.
Aus dem vorherigen Abschnitt geht hervor, das ALA/DHLA auf verschiedene Weisen antioxidativ wirkt. So habe ich in meiner (noch nicht veröffentlichten) Serie zu Nrf2 schon einiges zur ALA-Induzierten Hoch-Regulierung der antioxidativen (u.a. Glutathion-) Systeme geschrieben. Shay [10] schreibt hier unterstützend [12] (deepl.com):
“Alternativ könnte die Fähigkeit von LA, indirekt endogene Antioxidantienspiegel zu induzieren oder aufrechtzuerhalten, selbst in Zeiten von oxidativem oder toxikologischem Stress, relevanter sein als eine direkt wirkende antioxidative Rolle, und die Daten, die dies unterstützen, werden nun diskutiert.”
So induziert ALA denn auch die De-Novo Synthese von Glutathion auf transkriptionellem Wege, z.B. über die Erhöhung der Expression von γ-GCL (Glutamat Cysteine Ligase, dem ersten Schritt der GSH-Synthese) [32]. Dies geschieht durch von ALA/DHLA ausgelösten oxidativen Stress, welcher die Dissoziation von Keap1/Nrf2 bewirkt und in Folge die Expression antioxidativer Gene über ARE [4][12], was in die Produktion der antioxidativen Phase II & III Enzyme (‘der Entgiftung’) fördert. Das ALA Nrf2 (effektiv) und dosisabhängig induziert ist vielfach nachgewiesen [13][47][64][65].
Den oxidativen Stress über ALA und DHLA gibt es ‘gratis’, u.a. durch die Reaktion mit vorgenannten (freien) Radikalen, was in die Bildung von extrem kurzlebigen Thiol-Radikalen mündet. Die Thiol-Radikale reagieren mit DHLA-Radikalen, was in einen pro-oxidativen Effekt mündet. DHLA erhöht zudem die relative Menge an verfügbarem Fe2+ in der Zelle durch Chelatbildung und Reduktion von Fe3+ zu Fe2+, was dann mit O2 (Dioxid) zu O2– (Peroxid) reagieren kann – und ebenfalls pro-oxidativ wirkt [9]. Auch durch die Reduktion von anderen Übergangsmetallen durch ALA und DHLA wirkt zudem pro-oxidativ [10]. Zusätzlich könnte ALA auch Lipoyl-Cysteinyl-Mischdisulfide an Keap1 bilden und dadurch Nrf2 freisetzen [53] oder mit Sulfhydrylresten von Keap 1 reagieren [32][57].
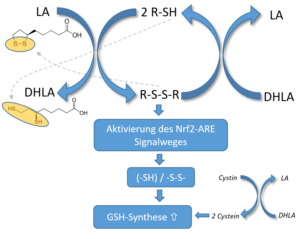
Nach Oxidation einiger Cysteinreste von Keap1 (durch Bildung von Lipoyl-Cysteinyl-Mischdisulfiden an Keap), der Struktur, die Nrf2 bindet und inaktiviert, erfolgt die Freisetzung und Aktivierung von Nrf2. Anschließend lokalisiert es sich im Zellkern, wo es das ARE-Gen bindet und das Transkriptionsgen für die Ligase GCH verstärkt, was die GCH-Aktivität und die GSH-Synthese erhöht.
Wie auch immer ALA bzw. DHLA Nrf2 induzieren – die Forschungen lassen keinen Zweifel daran, das ALA dies sehr effektiv macht- die Studienlage ist da ziemlich erschlagend [13][32][64][65]. Je nach Studie, Enzym, ALA-Dosis & Umständen finden sich verschiedenste Angaben zur Erhöhung von Enzymaktivitäten oder GSH in der Zelle. Eine Studie schreibt so [47]:
“Der Anstieg der GSTP-Enzymaktivität in Zellen, die mit 5 μmol/L SFN, 50 μmol/L DATS und 600 μmol/L LA und DHLA behandelt wurden, betrug 172, 75, 122 bzw. 117 % (P < 0,05)” (Anm.: 600µmol/L = 124 mg / L)
Meint: Mehr als eine Verdoppelung der GSTP-Aktivität durch ALA/DHLA. In Bezug auf die zeitliche Komponente der Hoch-Regulierung der GSH-Systeme habe ich 24 h für Zellkulturen und R-ALA gefunden, wobei nicht früher gemessen wurde [53]. Es gibt aber auch Messungen wo sich Maxima nach 30-60 Minuten einstellen [47]. Wie in meinem großen Artikel zu Nrf2 schon beschrieben, ist die Sache mit Nrf2 im Detail aber viel komplexer:
- Nrf2 hat eine kurze Halbwertzeit (<30 min), wobei das ganze Nrf2-Abhängige System
- über ARE wohl bis zu 10 Tage ‘hochmoduliert’ werden kann – bevor es zu einem negativen Feedback kommt.
- Ein hoher und schneller “Peak” (Anflutung im Serum/Plasma) ist wichtig um Nrf2 von Keap1 zu lösen,
- ein leerer Magen und optional eine liposomale Zubereitung sind die Schlüssel dafür.
- Eine Pulsung von Nrf2-Aktivatoren scheint relevant: 5-10 Tage ‘on’, 3-5 Tage ‘off’.
Um wirklich zu untersuchen was ‘ab geht’ müsste man alle 5-10 Minuten die Expression der Detox-Enzyme messen. Wenn sich in Folge einer Stress-Reaktion (z.B. ALA) Nrf2 innerhalb von Minuten von Keap1 löst und an ARE bindet – dann sollten sich die Ergebnisse, Enzymabhängig, schnell zeigen.
Hinweis: Der nachfolgende Abschnitt ist nur für eingeloggte Freunde des Blog lesbar
Allerdings, und das mag ich hier schon einmal anmerken, wenn Nrf2 (Epi-) genetisch blockiert ist – dann kann dieses wohl zu Unverträglichkeiten von ALA und anderen Thiol- und schwefehlhaltigen Substanzen führen: Denn ALA ist (auch) ein pro-oxidativer ‘Stressor’ – und wenn die antioxidative ‘Gegenreaktion’ ausbleibt, dann kann dies wohl zu Unverträglichkeiten führen. Dieses werde ich ggf. noch in einem extra Artikel ausführen.
ALA/DHLA und Schwermetall-Toxizität (Arsen, Blei, Cadmium) – Auswirkungen auf Glutathion, Nrf2, PARP-1, Akt, mTOR
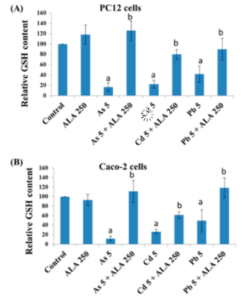
Intrazelluläre Spiegel von Glutathion (GSH) nach Exposition mit toxischen Metallen und/oder ALA, gemessen mit dem 5,5′-Dithiobis-2-Nitrobenzoesäure (DTNB)-Assay in (A) PC12-Zellen und (B) Caco-2-Zellen. Quelle: [68] Lizenz: CC BY SA.
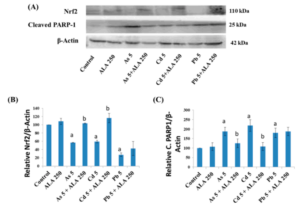
Western-Blot-Analyse der Proteinexpressionen und Quantifizierung von (B) Nrf2 und (C) gespaltenem PARP1 in den Caco-2-Zellen nach Behandlung mit Metallen mit ALA für 48 h. Quelle: [68] Lizenz: CC BY SA.
“α-Liponsäure (ALA) und seine reduzierte Form Dihydroliponsäure (DHLA) sind endogene dithiol Verbindungen mit erheblichen antioxidativen Eigenschaften, die beide das Potenzial haben, Zellen zu entgiften. In dieser Studie wurden ALA (250μM) und DHLA (50μM) zur Verringerung der durch Metalle (As, Cd und Pb) induzierten Toxizität in PC12- und Caco-2-Zellen bei gleichzeitiger Exposition eingesetzt. Beide verringerten signifikant den Cd (5μM)-, As (5μM)- und Pb (5μM)-induzierten Zelltod. Anschließend stellten sowohl ALA als auch DHLA die Integrität der Zellmembran und den intrazellulären Glutathion (GSH)-Spiegel wieder her, die durch die Metall-induzierte Toxizität beeinträchtigt waren.”
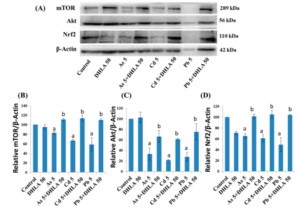
(A) Western-Blot-Analyse der Proteinexpressionen und Quantifizierung von (B) mTOR, (C) Aktund (D) Nrf2 in den PC12-Zellen nach Behandlung mit Metallen mit DHLA für 48 h. Die Werte der Balken zeigen den Mittelwert±SEM (n= 3). Dabei bezeichnet “a” einen signifikanten Unterschied im Vergleich zur Kontrollgruppe (p< 0,05), und “b” einen signifikanten Unterschied im Vergleich zur zugehörigen Metallgruppe (p< 0,05). Quelle: [68] Lizenz: CC BY SA.
- DHLA schützte PC12-Zellen vor metallinduzierten DNA-Schäden bei gleichzeitiger Exposition gegenüber Metallen.
- ALA und DHLA regulierten die Expression der mit dem Überleben verbundenen Proteine
- mTOR (mammalian target of rapamycin),
- Akt (protein kinase B) und
- Nrf2 (nuclear factor erythroid 2-related factor 2)
- in PC12-Zellen hoch, die zuvor durch die Metallexposition herunterreguliert wurden.
- ALA regulierte in Caco-2-Zellen bei gleichzeitiger Exposition mit Metallen
- Nrf2 hoch und
- gespaltenes PARP-1 (Poly (ADP-Ribose) Polymerase-1) herunter.
- ALA/DHLA verringerten die Schädigung der Zellmembran
- ALA und DHLA erhöhten signifikant den GSH-Gehalt in den untersuchten Zelllinien
- Der Schutz von ALA oder DHLA gegen Metalltoxizität sei wahrscheinlich größtenteils auf eine Verbesserung der antioxidativen Abwehr zurückzuführen.
Die Autoren folgern, das ALA und DHLA die Metalltoxizität in PC12- und Caco-2-Zellen entgiften, indem sie den oxidativen Stress reduzieren, Nrf2 aktivieren, die DNA-Fragmentierung hemmen, die Zellmembranschäden reduzieren und vor dem Zelltod schützen.
ALA & DHLA: Direkte Chelatoren von Schwer- und Übergangsmetallen
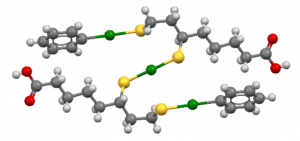
Die Struktur eines berechneten (theoretischen) Komplexes, der aus zwei DHLA-Molekülen, einem Hg2+-Ion und zwei Phenyl-Hg-Gruppen besteht. Quecksilber in grün, Schwefel in gelb und Sauerstoff in rot. Quelle: [31], Lizenz: CC BY SA 4.0
Bekannt ist, das ALA bzw. DHLA (durch seine zwei Thiol-Gruppen) komplexe mit Mn2+, Cu2+, Fe2+, Zn2+ [38] und anderen bilden. In einer Veröffentlichung von Biewenga [10], welche auch Cutler als Primärquelle nennt, gibt es dazu eine Übersicht über die potentiellen Chelatorenfähigkeiten von ALA und DHLA. Biewenga schreibt, das ‘in polaren, aber nichtwässrigen Lösungsmitteln gezeigt wurde’, dass Liponsäure Komplexe mit Mn 2+, Cu 2+, Zn 2+, Cd 2+ und Pb 2+ bildet. DHLA chelatiert Co2, Ni 2+, Cu 2+, Zn 2+, Pb 2+, Hg 2+ (in Verweis Brown und Edwards, 1970 [11]) und Fe 3+, was zu schwer wasserlöslichen Komplexen führt. Die Metaboliten Tetranor- und Bisnorliponsäure können Komplexe mit Cu 2+, Zn 2+, Cd 2+ und Pb 2+ bilden. Hier eine Übersicht als Tabelle aus [9] mit meinen Korrekturen, basierend auf [10]:
| Metall | Chelatbildung durch Alpha-Liponsäure | Chelatbildung durch Dihydroliponsäure |
|---|---|---|
| Pb2+ (Bleiionen) | Ja | Ja |
| Cu2+ (Kupferionen) | Ja | Ja |
| Zn2+ (Zinkionen) | Ja | Ja |
| Mn2+ (Manganionen) | Ja | — |
| Cd2+ (Kadmiumionen) | Ja | — |
| Co2+ (Kobaldionen) | — | Ja |
| Hg2+ (Quecksilberionen) | — | Ja |
| Fe3/Fe2+ (Eisenionen) | — | Ja (Fe3+ stabiler als Fe2+) |
| Ni2+ (Nickelionen) | — | Ja |
In dieser Tabelle ist auch anorganisches Quecksilber aufgeführt, auf das ich im nächsten Abschnitt im Detail eingehe.
ALA & DHLA: Direkte Chelatoren von Quecksilber (Hg)?
Brown et al. (1970) [11] waren aus meiner Sicht die ersten, welche die mögliche Verbindung von DHLA und anorganischem Quecksilber (Hg2+) thematisierten, da Ihre Beobachtungen ergaben, das zwischen DHLA und dem Quecksilberion (in vitro) ein Komplex gebildet wird. Aufgrund dieser Thematik und der Gehirngängigkeit von ALA besteht jedoch auch das potentielle Problem der Umverteilung von Schwermetallen, speziell Quecksilber, im Körper [3]. Meint: Bevor ALA zugeführt wird, sollte mit DMSA/DMPS vorab der Bestand bzw. Spiegel von Hg im Rest-Körper gesenkt werden.
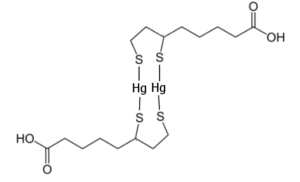
Eine mögliche chemische Struktur des Komplexes zwischen DHLA und Hg 2+, basierend auf den Überlegungen im Internationalen System (Basierend auf G. Bjørklund et al, 2019) [31]
Bjorklund et al. [31] merken an, das nur durch die Beteiligung mehrerer Ligandenanteile eine stabile lineare Formation mit zwei Thiolgruppen für jedes Hg2+ Metallion entstehen kann. Meint: Es braucht 2 DHLA-Moleküle um ein Quecksilber-Ion zu binden, wie auch im oben- und nebenstehenden stehenden Bild gezeigt. Dies, weil ein Hg-Molekül nicht zwischen die beiden SH-Gruppen von DHLA passt (wie auch bei DMPS und DMSA)
Chekmeneva et al. [45] bemerken, das sich ALA grundsätzlich bei mehreren Säugetierarten als schützend gegen die Auswirkungen einer akuten Quecksilbervergiftung erwiesen haben, vorausgesetzt, es wurde eine korrekte Dosierung von ALA verwendet. Auch bemerken Sie, das ALA derzeit den einzigen potenziellen Chelatbildner darstellt, der in der Lage ist, das zentrale und periphere Nervensystem zu erreichen – also die Blut-Gehirnschranke (BHS) zu überwinden. Hier mag ich anmerken, das diese Kriterium ggf. noch von Irminix erfüllt wird. Aber auch Hosain et al. [62] merken an, das ALA ein Chelatbildner sein könnte (deepl.com):
“Daher schlagen wir vor, dass die chelatbildenden Eigenschaften von DHLA mit Hg2+ stark für die Hemmung der Hg-Akkumulation und den daraus resultierenden Schutz von DHLA auf iHg-induzierte Toxizität in PC12-Zellen verantwortlich sein könnten.”
Zusammenfassend zeigten die Ergebnisse von Hossain et al., dass DHLA die Hg2+-induzierte Zytotoxizität über die Begrenzung der Hg-Akkumulation, die Verstärkung der antioxidativen Abwehr und die Hemmung der Apoptose in den Zellen abschwächen kann [62] und unterstützen damit die Sichtweise von Cutler [1], Gregus [27] und anderen.
Allerdings steht bis heute eine detaillierte Beschreibung der Hg2+-Komplexierung durch DHLA aus [45] Alle Nachweise für eine Komplexierung im Menschen (oder Tier) sind empirisch-hypothetisch (u.a. Cutler [1], basierend auf Gregus [27] und anderen) oder nur in der‘Petri-Schale’ (in-vitro) geschehen, wie z.B. [62]. Beim Menschen müsste dann noch sichergestellt werden, das der DHLA-Hg-Komplex auch über Niere & Urin und / oder Leber & Galle in den Dünndarm ausgeschieden wird. Damit dieser Komplex dahin gelangt, muss er aus der Zelle heraus, durch das Blut, in die Leberzelle und dort (über Membrantransporter wie BSEP, OATP und MRP1&2) in die Gallenkanäle ausgeschieden werden. Die jeweiligen pH-Niveaus müsste der Komplex ebenfalls überstehen – wie auch einer Re-Absorption im Darm entgehen, bis er final mit den Kot in der Toilette landet.
So ist z.B. Chris Shade (Quicksilver Scientific) der Ansicht, das ALA über Nrf2 indirekt die Glutathion-Systeme hochreguliert und das die im Stuhl bzw. der Galle messbare Hg-Ausscheidung [27] auf der Bildung von GSH-Hg-Komplexen beruht, nicht aber auf DHLA-Hg Komplexen [35][36]. Alles nicht so einfach….
Zellgängigkeit von ALA/DHLA, der NAD+ (NADH/NADPH) Metabolismus und Glutathion
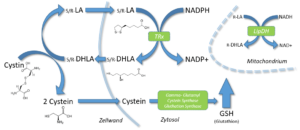
Die Haupttransformationen des LA/DHLA-Redoxpaares. Zelluläre Aufnahme von exogenem LA und seine extrazelluläre Freisetzung; die mitochondriale Reduktion von R-LA zu R-DHLA in Gegenwart von Dihydro-Lipoamid-Dehydrogenase und zytosolische Reduktion von S/R-LA zu S/R-DHLA in Gegenwart von Glutathion-Reduktase oder Thioredoxin-Reduktase. Die Verbindung zwischen dem LA/DHLA-System und der zellulären Cystein-Aufnahme und GSH-Synthese.
Alle Wirkungen von ALA/DHLA müssen für mich auch im Zusammenhang mit den NAD+-Metabolismus verstanden werden. In meinem Artikel zu Vitamin B3 hatte ich schon angedeutet wie wichtig NAD+ & Co. sind. Dabei gilt für mich:
- Ohne ALA kein DHLA,
- ohne genug NADH bzw. NADPH als Reduktionsmittel auch kein DHLA,
- ohne DHLA kein Cystein,
- ohne Cystein kein GSH und
- ohne DHLA auch keine Regenerierung von verbrauchtem GSH (GSSG), Vitamin C & E, sowie Q10 (zu Ubiquinol).
Wie nebenstehend zu sehen kann ALA auf mehreren Wegen durch enzymatische Reduktion zu DHLA reduziert werden [10]:
- In den Mitochondrien kann LipDH (Lipoamid-Dehydrogenase) auf Kosten von NADH, ALA reduzieren.
- Im Zytosol katalysiert die GSH-Reduktase (GSR) und die Thioredoxin-Reduktase (TxR) die Reduktion auf Kosten von NADPH.
So bewirkt die Gabe von ALA letztlich, dass sowohl das intrazelluläre (Anstieg von GSH und DHLA) als auch das extrazelluläre Milieu (Anstieg von DHLA und Cystein), auf Kosten des Verbrauchs von NAD(P)H stärker reduziert werden. Hier mag ich anmerken, das die kontinuierliche Reduktion von LA zu DHLA die Energieerzeugungskapazität der Zellen besonders bei hohen LA-Dosen belasten kann, speziell wenn niedrige NAD+-Spiegel vorliegen. [57, Seite 307]. Die Autoren von [57] merken jedoch an, das Abnahmen der NADH- und NADPH-Spiegel, von den Zellen wahrgenommen werden und wahrscheinlich den Glukosetransport hochregulieren, um den erhöhten Bedarf an reduzierenden NADH- und NADPH-Äquivalenten zu kompensieren. Was wo zum Einsatz kommt ist sehr Gewebespezifisch: So ist NADH (-> LipDH) zu 90% an der Reduktion von LA im Herzen, zu 63% in der Niere und zu 50% in der Leber beteiligt [53]. In Erythrozyten soll jedoch die TxR (und NADPH) die Hauptarbeit verrichten, wobei ALA und DHLA wohl sehr rasch die Zellmembran dieser Blutkörperchen passieren können [53].
Interessant ist, dass beide Enzyme eine entgegengesetzte Stereospezifität aufweisen, meint: Die Säugetier-GSH-Reduktase katalysiert die Reduktion von S-Liponsäure etwa doppelt so schnell wie die von R-Liponsäure (in Verweis auf Pick et al., 1995) und die Säugetier-LipDH reduziert das andere die R-Liponsäure, etwa 28-mal so schnell wie das S-Enantiomer (in Verweis auf Biewenga et al., 1996a) [10].
Damit ALA aber überhaupt in die Zelle kommt bedarf es spezieller Mechanismen: So soll u.a. der Natrium-abhängiger Multivitamin-Transporter (SMVT , im Magen- und Darmtrakt) und der Monocarbonsäure-Transporter (MCT) dieses bewerkstelligen, aber auch mittelkettige Fettsäure-Transporter in den Zellen. Zudem soll ALA die Zellmonolagen schnell und pH-abhängig durchqueren. Der Transport kann jedoch durch Verbindungen wie Benzoesäure und mittelkettige Fettsäuren gehemmt werden, was darauf hindeutet, dass der Monocarbonsäure-Transporter (MCT) der (oder ein) wahrscheinliche Träger für die intestinale Absorption von LA ist. [53][58]
Was bedeutet dies für mich?: Ohne genug NAD+ (-> Vitamin B3) spielt ALA sein Potential nicht aus, oder senkt die NAD(P)H-Spiegel ab. Zudem sollte ALA ggf. nüchtern eingenommen werden – zumindest jedoch nicht gelöst in mittelkettigen Fetten.
Pharmakokinetik – Bioverfügbarkeit & Absorption von ALA
Hinweis: Der nachfolgende Abschnitt ist nur für eingeloggte Freunde des Blog lesbar
Auch andere merken an, das um eine maximale Resorption zu erreichen, ALA bei leerem Magen einzunehmen sei – speziell bei Langzeiteinnahme [43]. Aus meiner Sicht ist dies auch beim Cutler-Protokoll relevant, wobei die Zufuhr mit dem Essen auch dazu genutzt werden könnte die Anflutung im Körper zu reduzieren und zeitlich zu strecken (siehe auch nebenstehendes Bild). Im zweiten Teil dieser Serie gibt es dann dann noch mehr zu den Halbwertzeiten der verschiedenen ALA-Formen.
Interaktionen von ALA (Biotin, Vitamin B5)
ALA konkurriert mit Vitamin B7 (Biotin) und Vitamin B5 um die Bindung an den Natrium-abhängiger Multivitamin-Transporter (SMVT) im Darm, so dass die langfristige (hochdosierte) Einnahme von ALA zu einem verringerten Vitamin-B7-Spiegel führen kann [7][8][33]. Die Verabreichung hoher Dosen von Liponsäure durch Injektion an Ratten senkte zudem die Aktivität zweier Biotin-abhängiger Enzyme um etwa 30%-35%, aber es ist nicht bekannt, ob eine orale oder intravenöse Supplementation mit Liponsäure den Bedarf an Biotin beim Menschen wesentlich erhöht [32]. Optimaler Weise sollte Biotin und Vitamin B5 (Pantothensäure) zu einem anderen Zeitpunkt als (hoch dosiertes) ALA verzehrt werden, um eine optimale Aufnahme aller Nährstoffe sicherzustellen [8].
Zudem habe ich noch einen Hinweis darauf gefunden, das 20 mg/kg RS-ALA (-> Intraperidontal verabreicht) bei Ratten mit starkem Vitamin B1 (Thiamin) Mangel tödlich waren [21]. Bezogen auf einen 70 Kg-Menschen sin dieses ca. 1400 mg RS-ALA. Was man davon ableiten kann ist für mich jedoch fraglich.
Sicherheit & Nebenwirkungen von ALA
Dieses Thema ist aus meiner Sicht ganz ‘heikel’, denn wenn eine Schwermetallbelastung mit Quecksilber (u.a. aus Amalgam) vorliegt, dann kann Alpha-Liponsäure diese erfahrungsgemäß mobilisieren, wodurch es zu starken Nebenwirkungen kommen kann. das ist kein Spaß, sondern ist vielfach dokumentiert und wird auch in Publikationen erwähnt [2] (Deepl.com):
“Die klinische Erfahrung zeigt, dass es vorsichtig eingesetzt werden muss, da es besondere Risiken der Umverteilung von Metallen birgt.”
Rebecca Lee, Co-Autorin des 2019er Buches von A. Hall Cutler zur Quecksilber-Ausleitung, schreibt denn auch folgendes in Ihrem Blog [40] (übersetzt mit deepl.com):
“Andy erwähnte einmal zu mir, dass der Missbrauch von Liponsäure ‘der Beitrag der Alternativmedizin-Gemeinschaft zum Quecksilber-Holocaust’ sei.”
Lee meinte damit das Problem der leichtfertigen Verwendung von ALA als Universalmittelchen bei Erschöpfung, Burnout, Diabetes & Co. Alpha-Liponsäure sollte denn auch immer im Kontext der Vorbelastungen und des Gesundheitsstatus zugeführt werden. Ist beides nicht möglichst genau bekannt, sollte auf die Nutzung von ALA aus meiner Sicht verzichtet werden, wie ich es auch schon in einem älterem Artikel beschrieben hatte. Bestehen die vorgenannten Probleme nicht, scheint ALA sehr sicher zu sein:
- (RS-)ALA wurde dem Menschen in Dosen von bis zu 1.200 mg intravenös ohne Toxizität verabreicht.
- In oralen Tagesdosen von bis zu 600 mg dreimal täglich (1800 mg) über 6 Monate [3][32] bzw.
- 1.200 mg/Tag über 2 Jahre (u.a. bei der Behandlung der diabetischen peripheren Neuropathie). [32]
- Dosen von 500-1.000 mg wurden in placebokontrollierten Studien gut vertragen. [3]
- Die orale Einnahme von 2.400 mg/Tag über zwei Wochen erwies sich auch in einer Pilotstudie, die Teilnehmer mit Multipler Sklerose einschloss, als sicher. [32]
- Bei Patienten mit diabetischer Neuropathie, die vier Jahre lang 600 mg/Tag Liponsäure einnahmen, gab es keinen signifikanten Unterschied in der Inzidenz unerwünschter Ereignisse und schwerwiegender unerwünschter Ereignisse im Vergleich zu den Patienten der Placebo-Gruppe [32].
Bei Ratten wurde eine LD50 von 2.000 mg/kg Körpergewicht beschrieben, wobei einige Ratten Anzeichen von vermindertem Wohlbefinden zeigten, einschließlich Sedierung, Apathie, Piloerektion, Buckelhaltung und/oder Augenschluss. Studien, die eine orale LA-Supplementierung bis zu 60 mg/kg pro Tag bei Ratten untersuchten, zeigten keine nachteiligen Effekte hinsichtlich Körpergewicht, histopathologischen Befunden und Blutanalysen. Daher wurde ein NOAEL (-> no observed adverse effect level) für Ratten von 60 mg/kg/Tag für eine Langzeit-ALA-Supplementierung angegeben. Letzteres entspräche für einen 70 Kg schweren Menschen 4.200 mg. [51]
Das LPI schreibt dann noch in seiner Zusammenfassung [32], das die am häufigsten berichteten Nebenwirkungen einer oralen Liponsäure-Supplementierung allergische Reaktionen der Haut, einschließlich Hautausschläge, Nesselsucht und Juckreiz sind. Es wurden aber auch Bauchschmerzen, Übelkeit, Erbrechen, Durchfall und Schwindel berichtet, und in einer Studie wurde festgestellt, dass die Häufigkeit von Übelkeit, Erbrechen und Schwindel dosisabhängig war. Darüber hinaus wurde übelriechender Urin bei Personen festgestellt, die 1.200 mg/Tag Liponsäure oral einnahmen. [32]. Nach Gregus [27] und Cutler [1] kann ALA zudem:
- die Bindung und Entfernung von Methylquecksilber (MeHg) aus der Leber hemmen.
- Darüber hinaus wird vermutet, dass es die Kupfer- und Zink-Ausscheidung aus dem Körper reduzieren kann, und wenn es im Übermaß oder über einen langen Zeitraum eingenommen wird.
Cutler [1] schlägt so vor, bei der Einnahme von Liponsäure wegen der möglichen MeHg & Kupferanreicherung im Körper Ruhepausen einzulegen. Askert [34] merkt an, das wenn zu viel ALA eingenommen wurde und starke Kopfschmerzen auftreten bzw. neurologische Symptome und Entzündungen sich verstärken, es wahrscheinlich ist, dass zu viele Schwermetalle auf einmal aus dem Gewebe freigesetzt wurden und nun im Blutkreislauf zirkulieren, und/oder Schwermetalle über die Blut-Hirn-Schranke (BHS) transportiert wurden.
Das Problem bei ALA ist nach Cutler: Der Metabolismus ist keine Einbahnstraße im Körper. ALA macht es für Quecksilber nur einfacher, zwischen dem Blut und dem Gehirn hin und her zu wandern – ALA schafft einen Ausgleich zwischen der Konzentration im Gehirn und Restkörper. Wer viel Hg im Gehirn hat, dem hilft die Einnahme von LA tendenziell sofort. Wenn jedoch mehr Hg im Rest-Körper hat als im Gehirn – bei dem kann ALA es potentiell in das Gehirn transportiert bzw. verschieben.
Da ALA (auch aus meiner aktuellen Sicht) in erster Linie auch ein Mobilisierungsmittel ist, sollte sie nicht (bzw. niemals) zu Beginn eines Entgiftungsprogramms bzw. einer Schwermetallausleitung eingenommen werden, sondern (frühstens) in der zweiten Hälfte eines Chelatierungsprogramms (inklusive fachkundiger Unterstützung) und idealerweise in Verbindung mit einem anderen Chelatbildner (z.B. DMPS oder DMSA), um die Schwermetalle zu binden, die aus dem Blut und den Geweben mobilisiert/ausgeleitet werden. Meint: Erst einmal den ‘Rest-Körper’ abräumen – bevor mit ALA begonnen wird um im Gehirn und auch Intrazellulär ‘Giftstoffe’ zu mobilisieren. Deswegen favorisiere ich erst einmal mit (langsam in der Dosis steigenden) DMPS-Runden das Hg im Blut und dem extrazellulären Bereich zu senken, bevor ich mit ALA in Kombination mit DMPS (als Netz mit doppeltem Boden) anfange auch das Gehirn und intrazellulär ‘abzuräumen’. Das alles natürlich nur nach einer umfassenden Vorbereitung mittels fach- und sachkundigem Therapeuten sowie ggf. zusätzlich einer zweiten Meinung in Form eines kompetenten Coaches.
Nebenwirkungsfazit: Durch die Mobilisierung von Schwermetallen & Giftstoffen bei entsprechend vorbelasteten Menschen und eher großzügigen Dosen um 600-1.200 mg / Tag erkläre ich mir dann auch die beschriebenen Nebenwirkungen bei der Verabreichung von ALA.
Warum “vertragen” manche Menschen 600-1200 mg ALA am Tag trotz Amalgam-Vergangenheit ‘problemlos’?
Genau diese Frage hatte ich in einem Cutler-Forum gestellt und folgende Antwort von einer Foristin (‘Linda’) erhalten. Ihr mögt sie als Anekdotisch einordnen, Ihr nicht glauben, aber aus meiner Sicht fasst diese das Dilemma sehr gut zusammen. In jedem Falle würde ich mal darüber nachdenken. Hier die Antwort:
“Wenn die Person Hg-giftig ist, würde sie mit jeder Dosis ALA ein winziges bisschen Quecksilber in das Gehirn und die Organe geschleust bekommen. Viele werden diesen winzigen Schlag durch ALA nicht bemerken, genauso wie ich viele Jahre lang keinen großen Schlag von der Amalgamfüllung bemerkte, und viele bemerken nicht jedes Mal einen Schlag, wenn sie eine Grippeimpfung bekommen, aber mit der Zeit bauen sich die Mengen auf und schließlich wird es eine Art von Funktionsverlust geben, den die Person vielleicht nicht mit der ALA in Verbindung bringt. Ich habe viele, viele Berichte von Menschen gelesen, die diese hohen, unregelmäßigen Dosen im Laufe der Zeit eingenommen haben und im Allgemeinen entwickelten sie schließlich einige neurologische oder psychologische Probleme, die sie erst mit ALA in Verbindung brachten, als sie schließlich anfingen, Andys Bücher zu lesen.“
Folgendes kann dann auch die unterschiedlichen Reaktionen auf verschiedene ALA-Dosierungen erklären. Problematisch ist, das ALA in sehr vielen Nahrungsergänzungsmitteln enthalten ist – teils in hohen Dosen. Beliebt ist alles was mit Multivitamin, Mitochondrien, Entgiftung und Leber zusammenhängt. Wer hier nicht ganz genau ließt – der kann, bei Amalgam-Vergangenheit, schnell viel Unheil für sich selber anrichten. Linda weiter:
“Die andere Verallgemeinerung, die ich aus der Lektüre so vieler Berichte machen kann, ist, dass Menschen, die ALA über einen längeren Zeitraum in hohen, unregelmäßigen Abständen eingenommen haben, eine viel schwierigere Zeit mit der Chelattherapie haben werden, wenn sie jemals dazu kommen sollten. Leider gibt es keine Studien zu diesem Thema.”
Und ich denke, das wird auch in Zukunft keine Studien darüber geben – weil kein finanzielle Interesse da ist diesen Punkt zu klären. So ist die Antwort auf die Frage der Überschrift: Die Menschen mit substantieller Amalgam-Vorgeschichte vertragen ALA oft nicht – nur realisieren Sie das nicht sofort am Anfang der Einnahme, sondern erst, wenn der Schaden da ist. So ist ALA grundsätzlich ein ‘geniales Zeug’ – nur eben für ca. 50-70% der Quecksilber-Belasteten Bevölkerung nicht unbedingt.
Ich mag hier noch anekdotisch anmerken, dass eine (forcierte) Schwermetallausleitung bzw. Mobilisation mittels ALA die Leber (und anderes) stark belasten kann. Was lange ‘gut geht’, kann bereits bei Dosierungen um 8 * am Tag um die 50-75 mg (~ 400-600 mg am Tag) ‘schief gehen’, also selbst, wenn ALA nach dem Cutler-Schema genutzt wird. So gibt es Menschen, die anfangs nicht einmal 5 mg RS-ALA alle 3 Stunden vertragen (~ 40 mg / Tag). Ich selber würde bei allen Dosierungen jenseits der 25 mg alle 3 Stunden (~ 200 mg / Tag) sehr vorsichtig sein und ggf. positive Erfahrungen nicht verallgemeinert wissen. Auch würde ich die Leberwerte (u.a. GOT, GPT, GGT) im Blick behalten – wie auch die Finger & Nägel der rechten Hand und die Zehen des linken Fußes. TCM-Erfahrene wissen warum.
Mein Fazit
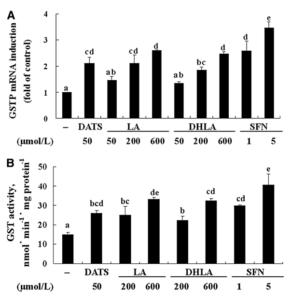
mRNA-Expression und Enzymaktivität von GSTP, induziert durch schwefelorganische Verbindungen. Die Zellen wurden mit DMSO allein (-) oder mit verschiedenen Konzentrationen von DATS, LA, DHLA oder SFN für 24 h behandelt. (A) Real-time PCR der GSTP mRNA-Expression. Der GSTP-mRNA-Spiegel in den Kontrollzellen wurde als 1 betrachtet. (B) GST-Aktivität bestimmt mit Ethacrynsäure als Substrat. Quelle: [47]
- a) die Auswirkungen in Bezug auf Symptomkrankheiten konzentrieren
- b) teils die zu Grunde liegenden indirekten antioxidativen Eigenschaften nicht genügend betrachten,
- c) hier speziell das Nrf2-/ARE-System und
- d) die Rolle als möglicher Schwermetall-Chelator für Quecksilber (Hg) im Menschen seit über 50 Jahren nicht vollends geklärt ist.
Insofern wird ggf. oft haarscharf um die wichtigsten und zu Grunde liegenden Eigenschaften herumlaviert. Gleiches passiert aus meiner Sicht bei den potentiellen Nebenwirkungen: Auch hier werden einzelne Symptome aufgeführt – die Ursache bleibt beim lesen der meisten Zusammenfassungen jedoch unklar. Nur wenige, u.a. Patrick [3] und Cutler [1], beschreiben klar, wo der ‘Hase (wohl) im Pfeffer’ liegt: Wenn der jeweilige Mensch eine beträchtliche Belastung mit Quecksilber hat. Dieses wird denn auch höchstwahrscheinlich mittels ALA mobilisiert und im Körper umverteilt – speziell, wenn die Leber und der Darm als Ausscheidungsorgane nicht “1a” funktionieren und die Last im Gehirn geringer ist als im Körper.
ALA kann so Segen und Fluch zugleich sein. Wer ALA mal eingenommen hat und den energetischen ‘Push’ bemerkt, weiß was ich meine. Allerdings sollte diese Einnahme, bei Belastung mit Schwermetallen, speziell Quecksilber, nur im Rahmen des Cutler-Protokolls geschehen – zumindest zum Anfang bei noch hoher Last mit Quecksilber. Wird zu schnell gesteigert, zu viel mobilisiert, dann kann die Leber schnell überlastet werden – was vielen erst auffällt, wenn die Leberwerte zu hoch sind, das Gesicht oder die Augen gelblich werden – oder die Kopfschmerzen und Übelkeit einem hoffentlich klar machen, das gerade massiv Quecksilber & Co. im Körper verschoben – aber nicht ausreichend ausgeschieden werden. Für die Ausscheidung bedarf es dann wiederum funktionierender Membrantransporter (-> u.a. OATP, MRP’s), genug Phosphatidylcholine (-> PEMT, MTHFR, Ernährung) und einer “gepflegten Leber” (-> u.a. check per Blutwerte: u.a. GOT, GPT, GGT).
Für den, der es ‘richtig’ macht, wobei nicht geklärt ist, was nun ‘richtig’ ist, kann ALA/DHLA anscheinend ein ‘Wunderwerkzeug’ im ‘Kampf’ gegen oxidativen Stress, Schwermetalle & Co. sein – wie auch die nebenstehende Grafik zeigt. ALA/DHLA regulieren u.a. die GST-Aktivität, die GSTP mRNA Induktion – und vieles andere – potent nach oben. Wer weiß wie dies zu nutzen ist hat einen neuen ‘Hammer’ in seiner Werkzeugkiste. Allerdings ist nicht alles ein Nagel – und so sollte auch dieser Hammer immer mit der nötigen Umsicht benutzt werden, denn das mobilisieren und verschieben von Quecksilber in die Organe, das Gehirn oder schlecht durchblutete Ort hat noch keinem genützt.
Links / Quellen
- [1] The Mercury Detoxification Manual: A Guide to Mercury Chelation, Rebecca Rust Lee and Andrew Hall Cutler, PhD, PE, 2019, ISBN 978-0-9676168-4-1
- [2] Amalgam Illness: Diagnosis & Treatment: What You Can Do to Get Better, How Your Doctor Can Help You, Andrew Hall, Ph.D. Cutler , 1. Juni 1999
- [3] Chelation: Harnessing and Enhancing Heavy Metal Detoxification—A Review, Margaret E. Sears, ScientificWorldJournal. 2013; 2013: 219840., Published online 2013 Apr 18. doi: 10.1155/2013/219840
- [4] Insights on alpha lipoic and dihydrolipoic acids as promising scavengers of oxidative stress and possible chelators in mercury toxicology, Geir Bjørklunda et al., Volume 195, June 2019, Pages 111-119, Journal of Inorganic Biochemistry, doi: 10.1016/j.jinorgbio.2019.03.019
- [5] Vitamin C, Glutathione, Or Lipoic Acid Did Not Decrease Brain Or Kidney Mercury In Rats Exposed To Mercury Vapor, H. Vasken Aposhian, Daniel L. Morgan, H. L. Sam Queen, Richard M. Maiorino & Mary M. Aposhianm, Journal Journal of Toxicology: Clinical Toxicology Volume 41, 2003 – Issue 4, Pages 339-347, Published online: 06 Feb 2003, doi: 10.1081/CLT-120022000 (Kritik von Cutler: Nr. 1, Nr. 2)
- [6] Mercury toxicity and antioxidants: Part 1: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity, Lyn Patrick, Altern Med Rev, 2002 Dec;7(6):456-71. (PDF)
- [7] Cloning and functional expression of a cDNA encoding a mammalian sodium-dependent vitamin transporter mediating the uptake of pantothenate, biotin, and lipoate., Prasad PD1, Wang H, Kekuda R, Fujita T, Fei YJ, Devoe LD, Leibach FH, Ganapathy V., J Biol Chem. 1998 Mar 27;273(13):7501-6.
- [8] Lipoic acid and Biotin: Is Supplemental Biotin Necessary? (Grenova)
- [9] Lipoic Acid: The Antioxidant Chameleon, J. R. Pfaffly, Biosciences Department,The University of Iowa, Iowa City, IA 52242, February 22, 2001
- [10] The pharmacology of the antioxidant lipoic acid, Gerreke Ph.Biewenga et al., General Pharmacology: The Vascular System, Volume 29, Issue 3, September 1997, Pages 315-331, doi: 10.1016/S0306-3623(96)00474-0
- [11] The reactions of 1, 3-dimercaptopropane, lipoic acid, and dihydrolipoic acid with metal ions, Phyllis R.Brown, John O.Edwards, Journal of Inorganic and Nuclear Chemistry, Volume 32, Issue 8, August 1970, Pages 2671-2675, doi: 10.1016/0022-1902(70)80316-5
- [12] Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential, Kate Petersen Shay, Biochim Biophys Acta. 2009 Oct; 1790(10): 1149–1160., Published online 2009 Aug 4. doi: 10.1016/j.bbagen.2009.07.026
- [13] Regeneration of glutathione by α-lipoic acid via Nrf2/ARE signaling pathway alleviates cadmium-induced HepG2 cell toxicity, Jiayu Zhang et al., Environ Toxicol Pharmacol, 2017 Apr;51:30-37., doi: 10.1016/j.etap.2017.02.022. Epub 2017 Feb 27.
- [14] Lipoic acid and dihydrolipoic acid. A comprehensive theoretical study of their antioxidant activity supported by available experimental kinetic data., Castañeda-Arriaga R1, Alvarez-Idaboy JR., J Chem Inf Model. 2014 Jun 23;54(6):1642-52. doi: 10.1021/ci500213p. Epub 2014 Jun 10.
- [15] An evaluation of the stability and plasma pharmacokinetics of R-lipoic acid (RLA) and R-dihydrolipoic acid (R-DHLA) dosage forms in human plasma from healthy volunteers., Carlson, D.A. & Young, K.L. & Fischer, S.J. & Ulrich, Heinz. (2008), doi: 235-270. 10.1201/9781420045390.ch10.
- [16] Insights on the Use of α-Lipoic Acid for Therapeutic Purposes, Bahare Salehi et al., Biomolecules. 2019 Aug; 9(8): 356., Published online 2019 Aug 9. doi: 10.3390/biom9080356
- [17] Pharmacokinetic study of lipoic acid in multiple sclerosis: Comparing mice and human pharmacokinetic parameters, Vijayshree Yadav, MD et al., Mult Scler. 2010 Apr; 16(4): 387–397., Published online 2010 Feb 11. doi: 10.1177/1352458509359722
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare