Freie Radikale und Oxidantien: O2-, H2O2, OH, NO und ONOO- (Superoxid, Hydroxyl, Wasserstoffperoxid, Peroxinitrid & Co.)

Formen freier Radikale (ROS) und des nitrosativem Stresses. Adaptiert auf Basis von [24].
- Was sind freie Radikale und wie entstehen Sie?
- Die bösen Seiten…
- Die guten Seiten…
- Die einzelnen Radikale und Oxidantien
- Superoxid (O2‾•)
- Wasserstoffperoxid (H2O2)
- Peroxid-Radikal (OOH‾)
- Hydroxyl-Radikal (OH•)
- Stickoxid-Radikal (NO•)
- Anm.: Wobei NO maximal wichtig und nützlich ist – nur nicht zu viel davon.
- Peroxinitrid (ONOO‾)
- Und etwas zu den Entgiftungs- und Entschärfungssystemen im Körper
- Also wie alles abgebaut wird – wenn alles im Körper gut funktioniert.
Wichtig vorab: Freie Radikale & Oxidantien (bzw. oxidativer Stress) sind nicht nur grundsätzlich schlecht: Sie sind auch ein wichtiger Abwehr & Kommunikations-Mechanismus im Körper (u.a. den Mitochondrien). Nur zu viel und zu lange (-> chronisch) ist der oxidative und nitrosative Stress nicht vorteilhaft und bedeutet Krankheit & Co. – aber dazu später mehr.
Inhaltsverzeichnis für den Schnellzugriff
Was sind freie Radikale (und Oxidantien) überhaupt – und wie entstehen Sie?
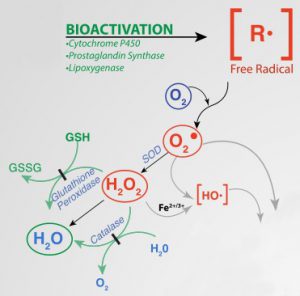
Mechanismus der durch Xenobiotika induzierten Toxizität freier Radikale (Ausschnitt). Quelle: Wikipedia, CC BY SA 4.0, Autor: Dan Cojocari
Freie Radikale, bzw. Reaktive Sauerstoff-Spezies (engl.: Reactive Oxigen Species, ROS) sind anorganische oder organische Verbindungen die oft sehr reaktionsfähig sind und als solche deswegen nur kurzfristig existieren. Im Detail [8][9]:
- Moleküle (-> zwei- oder mehr-atomige Teilchen),
- Ionen (-> elektrisch geladenes Atom oder Molekül) oder
- Atome
- jeweils mit einem (oder mehreren) ungepaarten (-> ‘einsamen’) Elektronen,
- welche durch einen –> • <– symbolisiert werden.
- Sie sind hochgradig reaktiv – meint, das Sie mit anderen Molekülen, Ionen, Atomen bzw. Stoffen chemische Reaktionen eingehen
- und diese damit verändern, zerstören bzw. teils noch schändlichere Radikale oder Oxidantien produzieren.
Freie Radikale entstehen in Organismen durch äußere (exogene) oder innere (endogene) Faktoren. Ein Beispiel für endogene Faktoren ist die Überlastung der ‘Verbrennungsprozesse’ in den Mitochondrien bzw. anders ausgedrückt: das die Elektronentransportkette (ETC) nicht perfekt funktioniert und Elektronen ‘leckt’, welche sich dann mit Sauerstoff zu Superoxid verbinden. Ein anderes Beispiel ist die Oxidation von NADH zu NAD+ im Citratzyklus (ETC Komplex I, NADH Oxidase) [9] – wo Superoxid ganz regulär entsteht.
Exogene Faktoren können dann chemischer oder physikalischer Natur sein. Beispiele sind hier u.a. [8]: Hitzeeinwirkung, UV-Strahlung, Ionisierende Strahlung, Röntgenstrahlung, Zigarettenrauch (ein Zug an der Zigarette bedeuten etwa 1014 freie Radikale [9]), Umweltgifte (Quecksilber, Schwermetalle, Chemikalien, etc.).
Die Oxidantien haben dann zwar kein ‘ungepartes Elektron’, aber auch eine hohe Affinität zur Reaktion mit anderen Verbindungen (z.B. ONOO‾ und H2O2). Dazu hatte ich hier schon was in Bezug auf Zerstörung von Aminosäuren (Tryptophan, Tyrosin & Co.) geschrieben. Letztendlich rauben Oxidantien anderen Verbindungen Elektronen und oxidieren Sie damit. Dadurch wird dann die Funktionsfähigkeit der Moleküle, Enzyme & Co. vermindert oder komplett eingeschränkt.
Freie Radikale (und Oxidantien) – die böse Seite
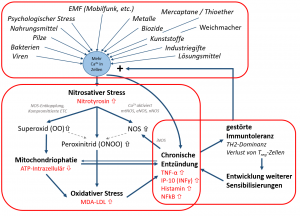
Die 3 Komponenten der selbstverstärkenden Kreisläufe der chronischen Entzündung. Bild basierend auf M. Pall und V. v. Baehr.
Wer hier schon länger im Blog ließt, der ist sicher schon über die Radikalen und Oxidantien wie Superoxid (H2O2) und Peroxinitrid (ONOO‾) gestolpert – speziell im Zusammenhang mit elektromagnetischen Feldern (EMF), chronischen Entzündungen, Nitrostress, EHS, MCS, CFS, und vielen mehr.
Das ist denn auch das Hauptproblem das ich sehe, also das äußerer (exogener) oder interner (chronischer) Stress, ob nun durch EMF, Chemikalien, Nahrungsmittel, Pilze, Kunststoffe, Industriegifte, chronische Entzündungen (u.a. Wurzelbehandlungen, CAP, NICO) oder Schwermetalle, die körpereigenen Entgiftungs- und Entschärfungssysteme auf Dauer überlasten. Alternativ können die internen Systeme auch kompromittiert (-> in Ihrer Funktion vermindert) sein – z.B. durch eine HPU, einen Gendefekt (GST/GPX) & Co. Was bedeutet das dann? Krankheit.
Dies, da freie Radikale biologisches Gewebe, Zellen und Moleküle in (oxidativen) Stress versetzten und diese dies dabei irreparabel zerstören (können). Hier können dann auch Kettenreaktionen verursacht werden, wenn durch die Reaktion mit einem nicht-Radikal-Molekül der Reaktionspartner ebenfalls als freies Radikal freigesetzt wird. Bei solchen Kettenreaktion werden dann funktionelle Moleküle zu unerwünschten bzw. dysfunktionellen Molekülen umgewandelt. Ist bei solch einer Reaktion dann auch DNA betroffen (u.a. die schlecht geschützte mitochondriale mtDNA), dann können diese molekularen Veränderungen Mutationen und andere Schäden verursachen, welche zu weiteren Krankheiten und auch Krebs führen können.
Der Körper hat zwar eigene Systeme um mit dem vermehrten oxidativen Stress fertig zu werden (u.a. Superoxid-Dismutase, Glutathion-Peroxidase, Katalase, Antioxidantien wie z.B. Glutathion und Ascorbinsäure) – aber auch diese Systeme haben Ihre Grenzen und können bei chronischer Belastung überfordert werden (z.B. weil die Baustoffe für genügend Glutathion fehlt).
Einige Menschen haben, wie schon angemerkt, eine ‘schlechtere’ genetische Ausstattung bei den Entgiftungssystemen (Stichworte: GST M1, P1, T1, SOD2, CYP1*, CYP2*, NAT2, PON1) [13], also so genannte Gen-Polymorphismen oder auch eine vorgenannte HPU. Kommen hier zu viele limitierende Varianten zusammen – dann besteht im allgemeinen deutlich weniger Toleranz gegenüber verschiedenen toxischen Umwelt-Belastungen Belastungen, welche oxidativen Stress auslösen.
Endogene Faktoren sind dann z.B. die Elektronentransportkette (ETC) in den Mitochondrien. Aus meiner Zusammenfassung von Lee Knows Buch:
“Das ‘Problem’: Die Passage der Elektronen ist nicht immer zu 100% Effizient – ab und zu verirrt sich mal ein Elektron und reagiert dann mit Sauerstoff zu Superoxid, einem so genannten (ungutem) freiem Radikal – was zu oxidativem Stress führt. So sind die Mitochondrien dann auch der Ort, wo am meisten freie Radikale im Körper ‘produziert’ werden – was ein wichtiger Aspekt beim Altern darstellt.”
Deswegen gilt nach Know auch die kalorische Restriktion als einer der Faktoren in Bezug auf die Lebensverlängerung:
“Eine Erklärung dafür liefert die ETC: Wenig Kalorien, weniger Elektronen (durch die ETC) und damit weniger freie Radikale. Auch umgekehrt wird ein Schuh daraus: Sehr viele Kalorien – speziell wenn diese nicht umgesetzt werden (also Arbeit, Sport, Bewegung) folgern mehr freie Radikale in den Komplexen der ETC.”
Der Ort wo am meisten freie Radikale gebildet werden ist nach Know der Komplex I. Mit Abstand folgt der Komplex III, welcher die Elektronen mittels Q10 von Komplex I & II erhält [11][12]. Im Normalfall ist der oxidative Stress der in den Mitochondrien entsteht kein Problem – er kann jedoch einer werden wenn Bausteine für wichtige Enzyme (-> so ziemlich alle Mikronährstoffe sind hier wichtig), Elektronentransporter (Q10, NAD(P)(H), FAD, etc.) oder Antioxidantien (u.a. Vitamin C, E, GSH) fehlen.
Leider gibt es jedoch heutzutage viele weitere ‘unnatürliche’ Quellen für oxidativen Stress – was dann die Last auf den Körper & Organismus deutlich steigert und aller Wahrscheinlichkeit das Leben verkürzt. Nicht umsonst sinken die Lebenserwartungen in den industrialisierten Ländern (u.a. Japan, USA) schon wieder. Dr. T. Levy fasst das ganze dann so zusammen, das für Ihm exzessive Oxidationsprozesse gleich Krankheit sein, egal wo nun die Ursache für die Oxidantien (bez. die Radikale) begründet sein mag: Durch chronische Entzündungen (NICOs/FDOK), bakteriellen Infektion, (chronischen) Viruserkrankungen, durch Schwermetalle, zu viel Calcium in den Zellen, durch EMF, etc. Im Original schreibt Levy [26, Seite 173]:
“Excess oxidation IS disease”
Merksatz: Pro-Oxidantien ‘klauen’ Elektronen und oxidieren damit andere Moleküle – Antioxidanzien (zuallererst Vitamin C) spenden Elektronen und reduzieren (-> ‘reparieren’ bzw. ‘recyceln’) damit die oxidierten Moleküle. Oxidierte Moleküle könne nicht mehr vernünftig (oder gar nicht mehr) ihre Funktion erfüllen – der Krankheit ist damit Tor- und Tür geöffnet. So einfach sind (in der Vereinfachung) die meisten Krankheiten zu erklären – siehe auch Pacher et. al. [5].
Freie Radikale (und Oxidantien) – die gute Seite
Freie Radikale, werden wie weiter oben schon abgesprochen, beim ‘Normalbetrieb’ gebildet – sind also durchaus ‘reguläre’ (bzw. normale) Stoffwechselprodukte mit denen der Körper auch gut umgehen kann und deren Menge durch zelleigene Enzymsysteme kontrolliert wird [10]. Insofern dürfen freie Radikale (und Oxidantien) nicht ausschließlich als ‘Feindbild’ betrachtet werden.
So haben freie Radikale (ROS) und Oxidantien dann auch eine Reihe von sehr positiven Funktionen:
- Sie ‘bekämpfen’ (oxidieren) beispielsweise Bakterien, Viren und werden dazu gezielt vom Organismus produziert (iNOS)
- Natürlich sollte solch ein Zustand nur kurz (einige Tage) anhalten.
- Wasserstoffperoxid ist u.a. und maßgeblich an der Enzymregulation beteiligt. [10]
- Nur als ein Beispiel für diese Thematik: So können, z.B. über den so-genannten Krüppel-Like Factor 1 (KLF-1), freie Radikale (ROS) so-genannte CPY-Gene (Entgiftung Phase 1) und andere Faktoren der xenobiotischen Entgiftung modulieren bzw. orchestrieren [14][15].
Lee Know führt letzteres dann auch in seinem Buch über Mitochondrien aus. Aus meiner Zusammenfassung:
“… jedoch scheint es, das diese freien Radikale auch eine signalisierende Wirkung haben. Zwar können die Radikale Schäden verursachen, jedoch aktivieren Sie wohl auch ‘redox-sensitive’ Transkriptionsfaktoren (Proteine für die Initiierung der RNA-Polymerase).”
So wird angenommen das das Mitochondrion diese Information (-> mehr oder weniger Radikale) im Kontext mit anderen Dingen (-> u.a. verminderte ATP-Produktion) ‘interpretiert’ und dann die Gene z.B. für die Produktion von z.B. Komplex IV aktiviert werden. So könnte es teils sogar nachteilig sein, mit zu vielen Antioxidatien bei Entzündungen & Co. gegenzusteuern. Die Autoren der Studie zu KLF-1 geben so zu bedenken [15]:
“Within the study, the researchers could show that higher levels of antioxidants given to the worms lead to a decreased lifespan by removing ROS and therefore blocking the signaling pathway.”
… zumindest bei Würmern 😉
Verschiedene freie Radikale und Oxidantien
Nun möchte ich ein paar dieser Moleküle und Verbindungen vorstellen: Wo Sie gebildet werden, wie sie ‘entschärft’ werden und ggf. weiteres was mir dazu einfällt.
Superoxid (O2‾•)
Das Superoxid-Anion entsteht u. a. in der mitochondrialen Atmungskette aus der Oxidation von NADH zu NAD+ (ETC Komplex I, NADH-Oxidase) und wird hauptsächlich durch die Superoxid-Dismutase (SOD) entgiftet:
O2‾• + O2‾• + 2H+ — SOD –> H2O2 + O2
Zudem wird in der Elektronentransportkette (insb. Komplex I und III) molekularer Sauerstoff (ca. 2 – 3 % des Sauerstoffverbrauchs [11][12] – alternativ 0.4-4% nach Know) schrittweise durch sogenannte ‘leckende’-Elektronen reduziert (also zu O2‾• gewandelt). Im ‘physikalischen richtig-schreib’: Superoxid entsteht aus der Verbindung von molekularen Sauerstoff (was ja ein Bi-Radikal mit zwei ungepaarten Elektronen ist) mit einem einzelnen Elektron durch die ‘reduktive Aufnahme eines Elektrons in eines der antibindenden p-Orbitale’.
Superoxid entsteht dann noch an vielen anderen Stellen, u.a. [9]:
- die Aldehyd-Oxidase,
- die Cytochrom-P450-Reduktase,
- durch die Autoxodation von Hämoglobin,
- reduzierten Riboflavinen (wie FMN und FAD),
- etc.
Eine weitere relevante Quelle sind Xenobiotika, welche durch ‚Redoxcycling‘ (-> Reduktion dieser Verbindungen durch Übertragung von Elektronen auf Sauerstoff), wodurch es auch zu einer Erschöpfung der zellulären Reduktionsequivalente NADPH & GSH kommen kann [13]. Ein weiteres Problem ist, das NO• mit O2‾• zu ONOO‾ reagieren kann, bevor das SOD-Enzym das Superoxid zu H2O2 entschärfen kann [7].
Problematisch ist das Superoxid wohl gerade auch im Zusammenhang mit der Lipidperoxidation, also von Fettsäuren und Zellmembranen [9].
Wasserstoffperoxid (H2O2)
Wasserstoffperoxid entsteht bei der ‘Entschärfung’ des Superoxid-Anions durch die Superoxid-Dismutase (SOD), aber auch bei vielen anderen enzymatischen Reaktionen. H2O2 wird dann durch die Katalase:
2 H2O2 —Katalase–> 2 H2O + O2
bzw. die Glutathion-Peroxidase, unter zur Nutzung von 2 * Glutathion (GSH) ‘entgiftet’:
2 GSH + H2O2 —Glutathion-Peroxidase–> GSSG + 2 H2O
wobei dann Glutathion Disulfid (GSSG) entsteht, was durch die Glutathion-Reduktase wieder zu GSH reduziert werden muss. Zudem kann Wasserstoffperoxid zusammen mit zweiwertigem Eisen zu dreiwertigem Eisen und dem Hydroxyl-Radikal reagieren (Fenton-Reaktion) [9].
Fe 2+ + H2O2 –> Fe 3+ + OH‾ + OH•
Spannend ist, das auch die Graufärbung von Haaren im Alter mit zu viel H2O2 verbunden wird [7]. Zwar färbt das Wasserstoff-Peroxid hier die Hare nicht direkt ‘Grau’ oder Weiß, jedoch konnte im Laborversuch gezeigt werden, dass Wasserstoffperoxid die Funktion des Enzyms Tyrosinase behindert (u.a. durch Methionin-Oxidation), was für die Melaninproduktion benötigt wird.
Warum im Alter auf einmal zu viel H2O2 ‘da ist’ und dieses nicht alle Haare trifft – konnten die Forscher noch nicht beantworten. Aus meiner Sicht könnte ein sehr plötzliches ‘grau werden’ im jungen Alter jedoch mit einer Ent- oder Vergiftungs-Problematik zusammenhängen und / oder schlechten ‘Genen’ bzw. mangelnden Co-Faktoren, welche den Abbau von H2O2 über die Catalase & Co. verlangsamen – oder auch einer HPU, weil ein B6-Mangel Katalase, Cytochrome-P450-Enzyme & Co. kompromittiert. Wer mehr wissen will, dem empfehle ich einen Artikel von Selfhacked zum Thema – wo dann auch Hintergründe besprochen werden [22]. Allerdings finde ich die Supplementeliste nicht gut – speziell auch nicht Fo-Ti. Das ist ein ganz übles Zeug für die Leber….
Hydroxyl-Radikal (OH•)
Das Hydroxyl-Radikal ist das zerstörerischste freie Radikal [17] und entsteht u.a. im Zusammenhang mit dem Eisen-Metabolismus in 2 Reaktionsschritten. Einmal bei der Reduktion von dreiwertigem Eisen (z. B. Speichereisen im Ferritin) zu zweiwertigem Eisen durch das Superoxid-Anion (Haber-Weiss Reaktion):
Fe 3+ + O2‾• –> O2 + Fe 2+
Sowie der Rück-Oxidation des zweiwertigen Eisens unter gleichzeitiger Spaltung von Wasserstoffperoxid:
Fe 2+ + H2O2 –> Fe 3+ + OH‾ + OH•
Zu viel (Speicher-) Eisen im Blut (-> Ferritin-Wert) scheint dann auch nicht allzu gut und ist mit einer Reihe von (u.a. neurologischen sowie entzündungsbasierten) Krankheitsbildern assoziiert [17][18][19]. Der Zusammenhang scheint die Erzeugung bzw. die Entstehung von zu viel Hydroxyl-Radikalen zu sein [17]:
“The close relationship between iron overload and pathogenesis of chronic disease can be explained in terms of the iron-induced hydroxyl radical generation and subsequent deposition of a fibrin-like material in various organs.”
Gerade intrazelluläres und nicht proteingebundenes Eisen spielen hier eine Rolle. Ebenso steht ein Überschuss an (freiem) Kupfer in Verdacht freie Radikale zu produzieren (-> Cu+ und H2O2 über die Bildung von OH•-Radikalen). Speziell ist dies wohl der Fall, wenn ein Mangel an Coeruloplasmin vorhanden ist. Aber es gibt auch andere Quellen für OH• wie die Generierung als Beiprodukt enzymatischer Reaktionen (Oxidoreduktasen, Xanthin- und NADPH-Oxidase) sowie bei der Elektronenübertragung von Flavinen und Chinonen. [9]
Stickoxid-Radikal (NO•)
Das Stickoxid-‘Radikal’ wird von der NO-Synthase (NOS) unter Abspaltung vom Arginin gebildet [1]:
Arginin + O2 —NO-Synthase–> NO• + Citrullin
NO• bewirkt eine reversible, kompetitive Hemmung der Cytochrom C-Oxidase (ETC-Komplex IV) und weiterer Enzyme innerhalb der ETC und des Citratzyklus. Vitamin B12 (speziell Hydroxocolbalamin [20]) ist ein Gegenspieler von NO•, was bedeutet das der so-genannte ‘nitrosative Stress’ durch (zu viel!) NO• sich wohl mit einem Mangel an Vitamin B12 verstärkt (und umgekehrt) [1][20]. NO wird in Bezug auf die reversible Hemmung von Komplex IV insbesondere auch eine (positive) Regulationsrolle in Bezug auch die mitochondriale Atmung, das Redox-Signalling und die Apoptose zugeschrieben [6].
Ergänzen möchte ich hier noch, das NO in keiner Weise schlecht ist – ganz im Gegenteil – es hat viele positive Effekte bei Gefäß-Gesundheit, Stoffwechselgesundheit, Langlebigkeit und Sport. Allerdings ist zu viel NO über lange Zeit gar nicht gut, speziell wenn es auch viel Superoxid gibt.
Peroxinitrid (ONOO‾)
Das Peroxinitrid-Anion entsteht durch die Verbindung des Stickoxid-Radikals mit dem Superoxid Anion [1][4][5]:
NO• + O2‾• —> ONOO‾
ONOO‾ macht so viele krasse Sachen – da weiß ich gar nicht wo ich anfangen soll. Pacher et al. [5] haben das ganze Thema mal auf ca. 110 Seiten mit ca. 750 Referenzen zusammen gefasst. Allerdings ist das schon wieder der Stand von 2006 (das Paper erschien Anfang. 2007). Im Kontrast zu Hydroxyl-Radikalen, welche langsam gebildet werden und sehr, sehr schnell in der Umgebung mit anderen Molekülen interagieren – wird Peroxinitrid extrem schnell bebildet (u.a. bevor die SOD das Superoxid entschärfen kann), reagiert dann aber recht langsam.
“Although peroxynitrite is a strong oxidant, it reacts at a relatively slow rate with most biological molecules. […] can still diffuse quite far on a cellular scale. Peroxynitrite is able to traverse cell membranes in part through anion channels.” und The contrast with hydroxyl radical is dramatic. Hydroxyl radical is formed by a rather slow reaction via the reaction of ferrous iron with hydrogen peroxide, but is so reactive that it can only diffuse about the diameter of a typical protein“.
Die langsame Reaktion hingegen verleiht einem Peroxynitrid-Anion einen recht großen ‘Aktionsradius’. Aus dem Paper von Pacher [5]:
“In contrast, peroxynitrite is formed each time superoxide and NO collide, but reacts slowly enough to react more selectively throughout the cell. That makes the biological and pathological implications of peroxynitrite far more interesting because it can have more subtle and specific actions on cells.”
Und das ‘far more interesting’ ist genau das große Problem von ONOO‾ – weil es eben nicht nur den lokalen Bereich um die NO-Synthasen schädigen kann. So hemmt ONOO‾ u.a. Cytochrom C-Oxidase der Atmungskette – und im Gegensatz zu NO• – nicht reversibel, sondern irreversibel. In einen Interview mit Lothar Hirneise, weißt dieser dann auch darauf hin, das die gestörte Cytochrome C Oxidase (ETC Komplex IV) nach Budwig ein wichtiger Punkt bzw. Gemeinsamkeit aller Krebs-Kranken sei. Weiterhin senkt viel Peroxinitrid auch die NO-Vorräte.
Aber auch Peroxinitrid ist nicht nur schlecht – im Rahmen der Immunabwehr kann der Körper über die iNOS (inductable NO-Synthase) auch sehr hohe Mengen an NO Produzieren, welche dann Pathogene zerstören sollen. Wie immer ist der Balance-Akt zwischen Gut & Böse eine heikle Sache.
Noch was zu ‘reduktivem Stress’ durch Antioxidantien
Wer nun meint sich maximal Antioxidantien ‘einschmeissen’ zu können und das dauerhaft – also z.B. Vitamin C, Vitamin E, Q10, Carotinide, Carnosin, Glutathion, etc. [23], der kann damit ggf. die Effekte von Sport / Training egalisieren [25]. Das ganze ist auch unter dem Stichwort ‘Reduktiver Stress’ (RS) bekannt – also Stress durch (zu viel) Antioxidantien.
Reduktiver Stress (RS) ist das Gegenteil des dem oxidativen Stress bzw. egalisiert diesen, wobei der ox-Stress, wie weiter oben schon angeführt, zur Signalisierung benötigt wird. Ohne Stressor-“Signal” auf das Systeme keine bzw. weniger Effekte durch Training [25]. Allerdings hat die angeführte Studie [25] einige Nachteile: Es wurde Vitamin E (400 IE) nur in der alpha-Tocopherol Form gegeben und bei Vitamin C ist “2* 500 mg am Tag” angegeben. Es findet sich jedoch keine Angabe, ob das Vit. C. vor oder nach dem Training genommen wurde bzw. in welchen Abständen. zum Training. Zum Vitamin E steht in der Studie “einmal am Tag” – es ebenfalls unklar wann es genommen wurde. So bleibt die Frage offen, ob nun Vit. C oder E für den Effekt verantwortlich war, oder beide und ob es bei beiden ggf. auch eine U-Kurve gibt bzw. der zeitliche Abstand vor/nach dem Training eine Rolle spielt.
In diesem Kontext habe ich noch eine weitere Studie zu Vitamin C & E gefunden (Literatur-Review), was dann keine dedizierten Effekte im Sinne des reduktiven Stresses gefunden haben will [27]. Aus der Studie:
“The major conclusions of this review are: (1) direct evidence for interference of ascorbate and α-tocopherol with exercise-induced ROS/RNS production is lacking; (2) theoretical analysis reveals that both antioxidants are unlikely to have a major impact on exercise-induced redox signaling; and (3) it is worth considering alternate redox-independent mechanisms.
Mehr noch: RS kann auch dazu führen das die Durchlässigkeit der Blut-Gehirn Schranke (negativ) beeinflusst und die Rate der Zellproliferation (-> Zellteilung / Vermehrung) verändert wird (-> je mehr RS durch Antioxidantien, je weniger Zellproliferation – so zumindest eine Studie [23]. Wer nun aus welchen Studien was macht, welche Dosierungen relevant sind – das übersteigt aktuell den Fokus dieses Artikels.
Mein Fazit
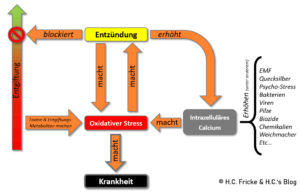
Der multiple Kreislauf aus Entzündung, exzessivem oxidativen Stress, Entgiftungsblockaden und Krankheit nach H.C. Fricke
Freie Radikale und Oxidantien gehören zum normalen Leben und den normalen Stoffwechselvorgängen dazu. Damit nichts (böses) passiert hält der Körper dann auch verschiedenste Enzym-System vor, welche die freien Radikale entschärfen bzw. reduzieren (-> SOD, Glutathion-Peroxidase, Glutathion-Reduktase, etc.) oder Substanzen die durch Elektronenabgabe direkt als Reduktionsmittel wirken (-> Q10, Vitamin C, etc.).
Problematisch wird es hingegen, wenn zu viele (schlechte) exogene Faktoren (u.a. EMF, Schwermetalle, Chemikalien, Umweltgifte, Lebensmittel-Zusatzstoffe, chronische Entzündungen, etc.) den Körper und seine Systeme stressen bzw. überfordern. Kommt es hierdurch, speziell in Kombination mit schlechter Ernährung und Lebenspraxis bzw. Lifestyle, zu vermehrtem bzw. chronisch übermäßigem oxidativen und nitrosativem Stress, dann wird es kritisch. Denn chronischer oxidativer Stress befördert den nebenstehenden Teufelskreislauf, was dann auch langfristig folgen hat[5].
Menschen bei denen die Entgiftungssysteme jedoch nicht so gut funktionieren (Stichworte: GST M1, P1, T1, SOD2, CYP1*, CYP2*, NAT2, PON1 [13] oder HPU), haben heutzutage aus meiner Sicht einen klaren Nachteil. Was vor 300 Jahren kaum ein Problem und auch vor 50-70 Jahren noch kein großes war – ist in unserer heutigen hyperbeschleunigten Welt, in der wir Konstant von Kunstlicht, elektromagnetischen Feldern und hundert tausenden von Mensch gemachten Chemikalien umgeben sind – ein großes Problem geworden. Einige Ärzte bezeichnen denn auch ca. 30% der Menschen als “genetische Verlierer” dieser (Fehl-) Entwicklung unserer (industriellen) Gesellschaft bzw. der dadurch erzeugten Umwelt….
Praktische Tipps
Was aus meiner Sicht wichtig scheint, ist das die körpereigenen antioxidativen und auch die Entgiftungssysteme so gut wie möglich unterstützt werden.
Wie geht das? Ganz einfach: Stressoren (also u.a. Gifte) meiden und genug Mikronährstoffe zuführen.
In jedem Falle würde ich auf Magnesium und Vitamine achten, in erster Linie genug Vitamin C. Über die normale Ernährung geht ein Teil – der andere dann (optimaler Weise) über eine sinnvolle Ergänzung. Bei Ascorbinsäure bin ich im Ernstfall (Infektion & Co.) nicht zimperlich – und orientiere mich an der gut dokumentierten klinischen Evidenz im zweistelligen Grambereich (verteilte Gesamt-Tagesdosis).
Wo das nicht ausreicht, kann ggf. auch etwas Selen (für die SOD), genug Zink, ein passend dosierter Vitamin-B Komplex, Glycin, Glutamin und bei niedrigem Cystein im Blut auch mit N-Acetyl-Cystein (für GSH) nachhelfen. Kupfer & Mangan (-> auch für die SOD) würde ich eher über Nahrung zuführen (als über Supplemente), da beide sehr pro-oxidativ wirken. Gleiches gilt auch für Eisen – wenn man nicht gerade eine Frau mit (teils bzw. oft) hohen Verlusten durch eine Regelblutung ist. Q10 scheint ebenfalls oft hilfreich – für die ATP-Produktion in den Mitochondrien (als Elektronen-Transporter) und gegen Peroxinitrid, wobei ich eher auch Vitamin C setzte.
Relevante Blutwerte?
In meinen Artikeln zu den Forschungen von Belpomme und denen von Baehr (Chronische Entzündungen & nitrosativer Stress) hatte ich schon einiges genannt, was man (neben den genetischen Faktoren) messen kann:
Hinweis: Der Rest des Artikels ist nur für eingeloggte Unterstützer sichtbar!
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.




Neuste Kommentare