Folat Teil 3: Methylierungs-Grundlagen, SAMe, Homocystein, die MTHFR-Mutation (C677T und A1298C), Auswirkungen, Diagnose und Nahrungsergänzung (B2, B6, B12, Folat und TMG)
Bereits 2017 schrieb ich einen Artikel zu Folat & Folsäure und das geschätzt ca. 80% der Deutschen zu wenig Folat mit der Nahrung zu sich nehmen. In dem Artikel stand auch etwas zu einer Mutation des sogenannten MTHFR–Gens. Was macht die Mutation? Sie bewirkt, dass ca. 10% der Europäer das Folat aus der Nahrung um bis zu 75% schlechter zum wichtigen Methlyfolat umwandeln können – und bis zu 40% der Europäer um ca. 17-50% schlechter. Was kann das bedeuten? Ganz viel: z.B. ein (zu) hohes Homocystein, wenig NAD+, wenig Phosphatidylcholine, Probleme mit dem Abbau der Neutrotransmitter, Probleme bei der DNA-Methylierung, Probleme mit Histamin (DAO), etc.
In der Praxis hängen die Problem mit dem Enzym MTHFR zusammen, das, vereinfacht geschrieben, durch das (gleichnamige) Gen ‘gesteuert’ wird. Das MTHFR-Enzym ist wichtig für den Methylierungs-Zyklus. In Letzterem kommen dann auch Vitamin B12 und andere Vitamine & Co-Faktoren (u.a. B2, B6 und TMG) zum Einsatz. Auch wenn es an diesen Co-Faktoren mangelt, kann das eingangs beschriebene Probleme wie eine ungünstige MTHFR-Mutation bescheren. Die Gene sind nur ein Faktor im ‘Spiel des Lebens’. Mit “blöder Ernährung”, schlechtem Lebenswandel & Co., kann der Mensch selber viel mehr Unheil anrichten.
In diesem Artikel möchte ich das Thema Methylierung, MTHFR und die Auswirkungen einer unter-Methylierung nun etwas weiter vertiefen. Speziell die Arbeiten und das (aus meiner Sicht hervorragende) Buch von Dr. Ben Lynch „Schmutzige Gene“ [1] haben mir hier viele neue Sichtweisen und Einblicke eröffnet, wobei ich mich hier aber auf das MTHFR-Gen beschränke. Themen in diesem Artikel sind dann:
- Was ist MTHFR? Unterschied zwischen Enzym und Gen
- Zur Mutation des MTHFR-Gens: C677T und A1298C
- Exkurs: MTHFR & der Methylierungs-Zyklus – wofür überhaupt der ganze Spaß?
- MTHRF, der Folat-Metabolismus, BH4, Serotonin, Dopamin und neurologische Störungen
- Wie kann eine Unter-Methylierung festgestellt werden (u.a. Blutwerte)?
- Wie kann der MTHFR-Status festgestellt werden – ohne Gentest?
- Was tun? Der Weg der Ernährung & Supplemente bei unklarem MTHFR-Status
- Was tun, speziell wenn Folat nicht ausreicht? Hinweise von Dr. Ben Lynch aus dem Buch ‘Schmutzige Gene’
- Ein wichtiger Hinweis zum Unterschied der L-5-MTHF-Folat und Folinsäure (z.B. Metafolin)
- Welche Supplemente nutze ich bzw. würde ich nutzen?
Hinweis: Bitte lest auch Teil 1 & Teil 2 meiner Serie über Folsäure & Folat:
- Teil 1: Warum synthetische Folsäure aus Supplementen eine eher schlechte Idee ist…
- Und der Unterschied zwischen Nahrungs-Folat, Folsäure und (L)-Methlyfolat
- Teil 2: Was unterscheidet die verschiedenen Folate (u.a. (L)-Methlyfolat, 5-MTHF, Quantrefolic & Co. )?
- Sowie etwas zu Dosierungen & Nebenwirkungen von zu viel Methylfolat (als Supplement)
Am Ende des Artikels folgt dann wie immer mein übliches Fazit.
Inhaltsverzeichnis für den Schnellzugriff
Was ist MTHFR? Unterschied zwischen Enzym und Gen
Die Methylentetrahydrofolat-Reduktase (MTHFR) ist ein Schlüsselenzym des Folat-Stoffwechsels. Die MTHFR wandelt 5,10-Methylentetrahydrofolat in die biologisch aktive Form des Folats, das 5-Methyltetrahydrofolat (5-MTHF), um. Dies ein wichtiger und begrenzender (-> ‘Rate-Limiting’) Schritt im Folat- und Methylierungs-Stoffwechsels, welcher direkt oder indirekt mit vielen anderen Prozessen im Körper im Zusammenhang steht.
Das MTHFR-Gen ist vereinfacht geschrieben der Bauplan für das MTHFR-Enzym, welches dem Körper die Anweisungen zur Herstellung dieses MTHFR-Enzyms gibt. Gibt es im Bauplan ein Problem, dann hat dieses Auswirkungen auf das ‘gebaute’ Enzym. Je nach der Art der Mutation im MTHFR-Gen kann das Enzym zwischen 17-75% in seiner Aktivität gemindert werden.
Dr. Ben Lynch weist in seinem Buch [1] jedoch auch darauf hin, dass durch Epi-Genetische Faktoren (u.a. Lebensführung, Umweltfaktoren) eine gute Genetik während des Lebens auch verschlechtert bzw. ggf. auch verbessert werden kann und dass ein ‘schmutziges’ MTHFR-Gen wahrscheinlich der häufigste aller SNPs mit relevanten Auswirkungen ist. [1]
Exkurs: MTHFR & der Methylierungs-Zyklus – wofür überhaupt der ganze Spaß?
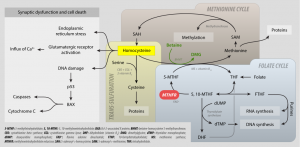
One-Carbon und MTHFR-Metabolismus. Quelle: Wikipedia. Lizenz: CC BY SA 3.0, Autor: Epgui
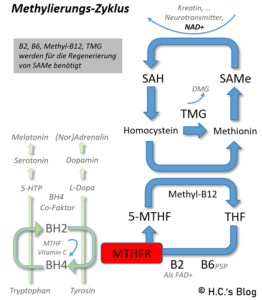
Wer auf die eingangs gezeigte Grafik von mit schaut, der wird sehen, dass das MTHFR-Enzym eine wichtige Rolle im sogenannten Methylierungszyklus, bzw. dem sogenannten (um Folat konzentrierten) Ein-Kohlenstoff-Stoffwechselweg (-> One-Carbon-Metabolism), hat. Dieser Zyklus ist essentiell für den Abbau von Homocystein zu Methionin und die Regenerierung von S-Adenosylmethionin (SAMe) einem sehr wichtigen Methylgruppenträger, der in vielen weiteren biochemischen Prozessen benötigt wird.
Lynch [1] nennt die MTHFR den “Methylierungsmeister”, weil es das Gen (bzw. Enzym) ist, welches den Methylierungszyklus in Gang setzt. So hängen mehr als zweihundert der lebenswichtigen Funktionen des Körpers von der Methylierung ab. Mit anderen Worten: Diese Funktionen brauchen Methylgruppen, um so zu funktionieren, wie sie sollen.
Unser MTHFR-Enzym ist ein wichtiger Spieler in diesem Prozess, indem es eine Methylgruppe an Folat weitergibt. Dieses Methylfolat interagiert dann z.B. mit Homocystein – und gibt die Methylgruppe an diesen weiter. Nun ist Homocystein methyliert und wird zu Methionin. Dieser Prozess setzt sich von einer Biochemikalie zur nächsten fort, in einer Art “Eimerbrigade” von Genen und Enzymen und Biochemikalien. Schließlich landet der Eimer in den Händen einer Biochemikalie namens S-Adenosylmethionin, oder SAMe (ausgesprochen “Samm-y“). Das ist der Spieler, der diese Methylgruppen letztendlich an die zweihundert Funktionen oder Prozesse weitergibt, die wir benötigen. Wenn der SAMe-Spiegel zu niedrig oder zu hoch ist, werden diese entscheidenden Prozesse im Rest unseres Körpers stark beeinträchtigt. Die Aufrechterhaltung der richtigen Menge an SAMe ist dabei ein feiner Balanceakt, und MTHFR spielt eine entscheidende Rolle in diesem Prozess. Aus diesem Grund ist es teils problematisch direkt mit SAMe zu ergänzen (als NEM) – und sollte der letzte Schritt (teure) sein, wenn die Ergänzung mit Folat nicht wirkt.
Nachdem SAMe seine Methylgruppen erfolgreich weitergegeben hat, wird es zu Homocystein. Homocystein ist das Endprodukt der Methylierung – aber es ist auch der Anfang: Wenn unser Körper gesund ist und der Methylierungszyklus gut funktioniert, wird Homocystein aufgenommen, methyliert und schließlich in SAMe umgewandelt – und der ganze Zyklus beginnt von neuem.
Grundsätzlich wirkt sich dann eine Reduktion der MTHFR-Aktivität (in)direkt negativ aus auf [7]:
- den Homocystein–Abbau zu Methionin [11],
- wobei alleine schon ein erhöhtes Homocystein ein unabhängiger Risikofaktor für Herzerkrankungen, Schlaganfall und andere Formen von Herz-Kreislauf-Erkrankungen ist,
- die Regenerierung von S-Adenosylmethionin (SAMe),
- die Synthese von Phosphatidylcholin (PC) aus Cholin mittels PEMT (ein anderes der Super-7 Gene nach Lynch [1]).
- die DNA-Methylierung (über SAMe) [5],
- die Kreatin-Synthese (etwa 70% des SAMe fließen da normalerweise hinein),
- die Bildung von 5-HTP (-> Serotonin, Melatonin) aus Tryptophan (indirekt, über BH4),
- die Bildung von L-Dopa (-> Dopamin, Adrenalin, Noradrenalin) aus Tyrosin (indirekt, über BH4),
- die regulatorischen T-Zellen und die Balance des Immunsystem,
- also die Verhinderung einer Th1/Th17-Dominanz sowie von Allergien (Th2-Dominanz),
- Neuralrohrdefekte, eine Gruppe von Geburtsfehlern, die während der Entwicklung des Gehirns und des Rückenmarks auftreten (wichtig für Schwangere) [3][11],
- die Ausscheidung von Arsen, Histamin und Estradiol (wird methyliert bzw. verbraucht Methylgruppen),
- sowie Assoziationen mit Makuladegeneration, Alzheimer-Krankheit, Hörverlust und Krebs [3][11]
um nur einige zu nennen. Eine MTHFR-‘Unterfunktion’ nennt man dann auch Hypo-Methylierung. Joe Cohen von Selfhacked merkt noch mal an, das MTHFR-Mutationen nicht an all diesen Gesundheitsrisiken schuld sind. Nach den klinischen Studien die er und sein Team ausgewertet haben, sind MTHFR-Mutationen nur dann ein Problem, wenn der Homocysteinspiegel hoch oder der Folatspiegel niedrig ist. (Anm.: Aus einem personalisiertem Gen-Report). Eine weitere wichtige Rolle von MTFHR ist die Beteiligung an der Spende von Methylgruppen zur Regulierung der epigenetischen Modifikation im Ein-Kohlenstoff-Stoffwechsel. [5]
Tiefer Exkurs: Folat selber hat zwei wichtige Kohlenstoff-Kohlenstoff-Doppelbindungen. Die Sättigung einer davon ergibt Dihydrofolat (DHF) und das Hinzufügen eines zusätzlichen Wasserstoffmoleküls über die zweite ergibt Tetrahydrofolat (THF). Folate dienen als Spender von einzelnen Kohlenstoffen in einem von drei Oxidationszuständen: 5-Methyl-THF (CH3THF; reduziert), 5,10-Methylen-THF (CH2THF; intermediär) und 10-Formyl-THF (CHOTHF; oxidiert). Der Ein-Kohlenstoff-Donor CH3THF, also das 5-MTHF, wird dann verwendet, um Homocystein in Methionin umzuwandeln, das (über SAMe) zur Methylierung von DNA verwendet werden kann. Das CH2THF geht dann in die Thymidylat-Synthese (dUMP, dTMP -> Relevant für die DNA-Synthese) und CHOTHF in die de-novo-Purinsynthese. ‘Globalgalaktisch’ hat das alles natürlich noch viel mehr Interaktionen – ich denke jedoch, das dieses zur Einführung die wichtigsten Aspekte sind.
Zur Mutation des MTHFR-Gens: C677T und A1298C
Nur kurz zur Einführung: Unsere DNA ist wie eine lange Schnur, die in jeder Zelle unseres Körpers enthalten ist. Entlang dieser Schnur befinden sich sogenannte ‘Nukelinbasen‘, die wie Perlen aufgereiht sind. Es gibt vier Basen, die mit den Buchstaben: Adenin (A), Guanin (G), Cytosin (C) und Thymin (T). Diese reihen sich in sehr spezifischen Sequenzen aneinander, um Gene zu bilden. Unsere einzigartige genetische Ausstattung ist in der Abfolge dieser Basen gespeichert.
Die von diesen Basen gebildete Sequenz variiert von Mensch zu Mensch. An einer bestimmten Stelle in einer Sequenz können beispielsweise 75 % der Bevölkerung ein “G” haben, während die anderen 25 % ein “A” haben. Der Unterschied liegt nur in einer einzigen Base, daher wird diese Art der genetischen Variation als Einzelnukleotid-Polymorphismus (SNP) (-> ausgesprochen ‘Snip’) bezeichnet. In diesem Beispiel hat der SNP nur zwei mögliche Variationen: “C” oder “T” (z.B. C677C, C677T, T677T).
Wir erben zwei Kopien von jedem Gen: Eines von der Mutter und eines vom Vater. Im Fall des obigen Beispiel-SNPs würden wir, wenn wir von jeder Variante eine tragen (z. B. “CT”), als heterozygot für diesen SNP gelten. Würden wir zwei der gleichen Varianten tragen (“CC” oder “TT”), wären wir homozygot für diesen SNP. Diese Zwei-Buchstaben-Bezeichnungen sind unser ‘Genotyp’ für ein bestimmtes Gen. In meinem 23AndMe-Artikel gibt es dann noch ein paar weitere Informationen wie man so etwas testen kann.
Im MTHFR-Gen wurden so aktuell 14 häufige oder seltene SNP’s (also Varianten) identifiziert, die mit einer reduzierten Enzymleistung verbunden sind. Unter ihnen sind die Varianten C677T (rs1801133) und A1298C (rs1801131) die am häufigsten berichteten Varianten, welche die MTHFR-Aktivität in verschiedenen Graden reduzieren können. Für C677T beträgt die Enzymaktivität von heterozygoten (CT) und homozygoten (TT) mutierten Individuen 67 bzw. 25 % (oder auch weniger) des ‘Normal’. Und für A1298C liegt die Enzymaktivität von heterozygoten (AC) und homozygoten (CC) mutierten Individuen bei 83 bzw. 61 % des ‘Normal’.
Hier noch mal als Tabelle mit Angabe der Enzymaktivität für den besseren Überblick, inklusive einer Mischung der Heterozygotie beider Gen-Varianten [2][9][10]:
| Normal (Homozygot) | Mutation (Heterozygot) | Mutation (Homozygot) | Mischung |
|---|---|---|---|
| 100% (C677C) | 67% (C677T ) | 25% oder weniger (T677T) | 36-48% (A1298C/C677T) [15] |
| 100% (A1298A) | 83% (A1298C) | 61% (C1298C) | < 20% ??? (T677T/C1298C) |
Die Forschung zeigt, dass unabhängig davon, wie viel Folat konsumiert wird, das homozygote C677T (T677T) Probanden immer deutlich niedrigere Folatspiegel haben als heterozygote C677T. In der Folge haben diese Menschen (in der Regel) auch bemerkenswert höhere Homocystein-Konzentrationen als alle anderen – am stärksten ausgeprägt, wenn die Folataufnahme niedrig ist. [10][11]
Für den C677T ist das Vorkommen (-> die Prävalenz) in der Allgemeinbevölkerung relativ hoch (ca. 30-40% teils werden auch bis zu 50% angegeben [3]), wobei die Homozygote Variante (T677T) nur in 5-15 % der weißen Populationen vorkommt [10]. Allerdings möchte ich anmerken, dass das Vorkommen beider Varianten je nach Ethnie und Region deutlich verschieden sein kann. Wenn Zweifel bezüglich des eigenen MTHFR-Status bestehen hilft letztendlich nur das Bestimmen per Anamnese bzw. Gentest. Für die Bestimmung per Anamnese auf Basis der Symptome gibt Ben Lynch [1] die besten Tips & Hinweise inkl. Leitfäden.
MTHRF, der Folat-Metabolismus, BH4, Serotonin, Dopamin, neurologische Störungen & mehr
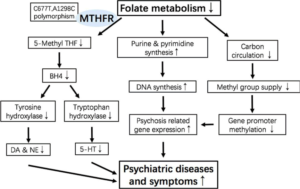
Mögliche Mechanismen der MTHFR bei psychiatrischen Erkrankungen. Die Methylgruppenversorgung im Ein-Kohlenstoff-Stoffwechsel wird durch den katalytischen Prozess des MTHFR-Enzyms beeinflusst. Der MTHFR-Polymorphismus beeinflusst die nachgeschaltete Methylierung von Schizophrenie-bezogenen Proteinen. DA, Glutamat und so weiter. BH4: Tetrahydrobiopterin; DA: Dopamin; NE: Norepinephrin; 5-HT: 5-Hydroxytryptamin. Quelle: [5], Lizenz: Creative Commons Attribution 4.0 International License
- Tryptophan-Hydroxylase (-> 5-HTP, Serotonin, Melatonin)
- Tyrosin-Hydroxylase (-> L-Dopa, Dopamin, Noradrenalin, Adrenalin)
direkt von BH4 abhängig sind, wobei die Regeneration von BH2 zu BH4 Vitamin C [8] und des reduzierten Folats der MTHFR bedarf. Zahlreiche Studien haben gezeigt, dass der Grad des MTHFR-Polymorphismus im C677T-Kontext mit dem Risiko einer Schizophrenie assoziiert ist und auch einen Einfluss auf die Symptome der Schizophrenie hat. Zum Beispiel ist eine erhöhte T-Allel-Belastung mit der Zunahme des Schweregrads der Negativsymptome bei Schizophrenie verbunden, während eine Verringerung des Schweregrads der Positivsymptome ebenfalls beobachtet wurde. Allerdings könnte der Effekt des T-Allels auf die Negativsymptome der Schizophrenie durch Folatmangel noch verstärkt werden. [5]
Zusätzlich zur Schizophrenie zeigte eine Studie eine Assoziation zwischen dem homozygoten T677T-Genotyp des MTHFR-Gens und der bipolaren Störung mit einer stärkeren Verknüpfung bei männlichen Patienten als bei weiblichen Patienten. Depressionen sind eine weitere wichtige psychiatrische Erkrankung. MTHFR-Polymorphismus wird auch bei Patienten mit Depression festgestellt und Studien ergaben, dass MTHFR-Polymorphismen mit der Episode und der Prognose der depressiven Störung zusammenhängen könnten, nicht jedoch mit dem Stadium der Erkrankung. [5]
Das Tetrahydrobiopterin (BH4) hat neben der Bedeutung für das Nervensystem, wichtigen Hormonen, Monoamin-Neurotransmittern, vorgenannten Katecholaminen (Dopamin, Adrenalin, Noradrenalin) und Indolaminen (Serotonin und Melatonin) auch für die Stickoxidsyntheasen (NOS) relevant und beeinflusst über die NOS den angrenzenden Harnstoffzyklus. [7] Im Kontext Abbau von Neurotransmittern, hier wird dann SAMe gebraucht, denn ein Überschuss der Neurotransmitter kann ebenso unerwünscht sein, wie ein Mangel. So sind die MAO und COMT abhängig von SAMe aus dem Methylierungs-Zyklus [7]:
- Monoaminoxidase (MAO): desaminiert Amine (wie Adrenalin, Noradrenalin und Dopamin) zu Aldehyden.
- Catechol-O-Methyltransferase (COMT): Baut Katecholamine (Dopamin, Adrenalin, Noradrenalin) ab.
Wie kann eine Unter-Methylierung festgestellt werden (u.a. Blutwerte)?
Ein Gen-Tests auf MTHFR kann helfen das potentielle genetische Risiko zu ermitteln. Ein Serum-Folat-Test scheint auf den zweiten Blick das Mittel der Wahl – aber Folat ist ein ‘schlüpfriger’ Begriff, wie wir bereits in Teil 1 der Folat-Serie gesehen haben. Bei einem Serum-Folat-Test misst ein Labor sowohl die künstliche Folsäure (aus Nahrungsergänzungsmitteln und ‘angereicherten’ Lebensmitteln), als auch natürliche Folate (aus Vollwertkost). Werden die einzelnen Folat-Formen (THF, 5-MTHF & Co.) nicht unterschieden, dann sagen die Ergebnisse faktisch nichts aus. Ein zweiter Weg ist der Test auf Blutwerte, welche in Folge einer potentiellen Unter-Methylierung nicht in Ordnung sein könnten [7]:
- Histamin
- Die Histamin abbauende Histamine N-methyltransferase (HMNT) ist SAMe-Abhängig. Bei mangelhafter Methylierung steigt deshalb der Histaminspiegel im Blut an. Da die HMNT jedoch nur für etwa 70% des Histaminabbaus verantwortlich ist (den Rest erledigt die DAO), ist das ganze nicht eindeutig. Zudem gibt es auch noch Mutationen bei HMNT und DAO, so das ein zu hoher Histamin-Wert auch daran liegen könnte. Insofern gilt grob:
- Ist das Histamin extrem hoch, bestätigt dies einen Verdacht einer Unter-Methylierung.
- Ist das Histamin sehr niedrig, kann von einer guten Methylierung /oder guten Folat-Versorgung) ausgegangen werden.
- Die Histamin abbauende Histamine N-methyltransferase (HMNT) ist SAMe-Abhängig. Bei mangelhafter Methylierung steigt deshalb der Histaminspiegel im Blut an. Da die HMNT jedoch nur für etwa 70% des Histaminabbaus verantwortlich ist (den Rest erledigt die DAO), ist das ganze nicht eindeutig. Zudem gibt es auch noch Mutationen bei HMNT und DAO, so das ein zu hoher Histamin-Wert auch daran liegen könnte. Insofern gilt grob:
- Ratio von SAM(e) zu SAH
- Dies ist das Verhältnis von S-Adenosyl-Methionin (SAMe) zu seinem Abbauprodukt S-Adenosyl-Homocystein (SAH). Liegt deutlich mehr SAH vor (Verhältnis stark in Richtung SAH verschoben), dann liegt potentiell eine Unter-Methylierung vor.
- Homocystein
- Das Homocystein steigt bei einer Störung der Methylierung an – allerdings auch bei einem Mangel an B6, B12 und ggf. auch B2.
- Ben Lynch gibt optimale Werte um 7-8 an, wobei ein Homocystein unter 6 auch wieder problematisch sein kann, da dieses für die Bildung von Glutathion benötigt wird [1] oder es z.B. zu wenig SAMe/SAH gibt, was zwar wenig Homocystein zur Folge hat, jedoch für den Preis von zu wenig SAMe.
In Bezug auf den letzten Punkt könnten dann, bei Verdacht auf ein Unter-Methylierung, auch B12 und ggf. B6 gemessen werden. Aus meiner Sicht waren B6-Werte jedoch oft nicht ‘konklusiv’ (speziell bei einer HPU) und B12 (im Serum) sollte unbedingt über 800 liegen. Oft macht es jedoch mehr Sinn, einfach alle B-Vitamine mit einem Mindestmaß zu ergänzen – und Folat, B12 und B6-P5P nach je nach Bedarf. Der Methylierungs-Zyklus kann aber auch blockiert sein, u.a. durch:
- Schwermetalle, Industriechemikalien,
- Entzündungen, oxidativen Stress (freie Radikale), Infektionen
- Folsäure (die Ihre Folatrezeptoren blockiert), Mangel an benötigten Nährstoffen (B2, B6, B12, Zink, etc.),
- eine bakterielle oder Hefe-Überwucherung des Dünndarms,
- eine Schilddrüsen-Unterfunktion und (psychologischen) Stress.
Zwar gibt es auch eine Übermethylierung, welche z.B. mit dem SAMe/SAH Verhältnis festgestellt werden könnte (u.a. durch zu viel 5-MTHF Folat). Alternativ kann dieses noch durch eine gestörte Kreatin-Synthese (u.a. Mutation der Gene AGAT oder GAMT) passieren, weil in diesem Fall das SAM nicht verwertet werden kann und weiter im Körper zirkuliert. [7]
Es gibt dann noch die Perspektive von Dr. William Walsh, der Datensätze von über 3 Millionen Patienten, darunter den Methylierungsstatus von über 30.000 Patienten gesammelt hat. Walsh hat herausgefunden, dass es unmöglich sei, nur eine Handvoll genetischer Variationen (SNPs) zu betrachten und irgendwie darauf zu schließen, welchen Gesamteffekt auf die Methylierung die etwa 1.000 SNPs der Menschen haben. Stattdessen hat Dr. Walsh durch klinische Erfahrung gelernt, dass die Verwendung von Vollblut-Histamin oder das SAMe/SAH-Verhältnis viel bessere Möglichkeiten sind, den Gesamt-Methylierungsstatus zu bestimmen, was die Hinweise von Lynch stützt. [20]
Wie kann der MTHFR-Status festgestellt werden – ohne Gentest (nach Dr. Ben Lynch)?
Zu dieser Frage gibt uns Ben Lynch Antworten und Fragen mit auf den Weg [1]. Häufige Anzeichen für ein MTHFR-Polymorphismus bzw. Folat-Mangel sind Angstzustände, Hirnnebel, chemische Empfindlichkeit, Depressionen, Reizbarkeit und ein aufbrausendes Temperament. Wer sich hier irgendwo wieder findet sollte weiter machen und sich in einem ersten Schritt folgende 5 Fragen beantworten [1]:
- Ich leide unter Kopfschmerzen.
- Ich schwitze leicht und stark bei sportlicher Betätigung.
- Ich nehme Ergänzungsmittel mit Folsäure ein und/oder esse Lebensmittel, die mit Folsäure angereichert sind.
- Ich kämpfe mit Depressionen.
- Ich habe kalte Hände und Füße.
Jedes “Ja” ist ein Punkt, wobei dann folgende Auswertung gilt:
- 0-1 Punkte: Dieses Gen ist wahrscheinlich recht sauber und funktioniert gut.
- 2 Punkte: Dieses Gen könnte ein bisschen schmutzig zu sein, kann aber höchstwahrscheinlich durch optimierte Lebensführung kompensiert werden.
- 3-5 Punkte: Hier liegt ein potentielles Problem vor dem nachgegangen werden sollte.
Wer 3-5 Punkte hat, dem gibt Lynch weitere 11 Fragen an die Hand welche einen Verdacht auf einen MTHFR-Einschränkung oder Methylierungs-Problematik verstärken können:
Der nächste kurze Abschnitt ist nur für eingeloggte Freunde des Blog lesbar.
Anmerken möchte ich hier noch, dass natürlich auch viele andere Dinge dazu führen können, dass die beschriebenen Symptome auftreten. Diese Fragen ersetzten keine vollständige Anamnese eines Therapeuten (u.a. Blutwerte, Begutachtung von Organen) – sollten jedoch ein fester Bestandteil eines (erweiterten) Anamnesegespräches sein. So könnten noch folgende Symptome typisch für MTHFR sein [1]:
Der nächste kurze Abschnitt ist nur für eingeloggte Freunde des Blog lesbar.
Sowie folgende Krankheiten [1]:
- Neurologisch: Alzheimer-Krankheit, Autismus, Bipolare Störung, Epilepsie, Schizophrenie, Parkinson-Krankheit, ungeklärte neurologische Erkrankung, Postpartale Depression,
- Krebs: Blasenkrebs, Brustkrebs, Plattenepithelkarzinom der Speiseröhre, Magenkrebs, Leukämie, Schilddrüsenkrebs,
- Herz & Kreislauf: Atherosklerose, Herzgeräusche, Bluthochdruck, Blutgerinnsel, Myokardinfarkt (Herzinfarkt), Angeborene Herzfehler, Schlaganfall,
- Geburt: Fehlgeburten, Plazenta-Abriss, Schwangerschafts- und geburtsbedingte Komplikationen, Präeklampsie, Geburtsdefekte,
- Darm & Co.: Reizdarmsyndrom, Chemikalienempfindlichkeit (MCS), Chronisches Müdigkeitssyndrom (CFS),
- Autoimmun & Co.: Multiple Sklerose, Fibromyalgie, Asthma, Lungenembolien, Down-Syndrom
- Sonstiges: Migräne mit Aura, Glaukom, Männliche Unfruchtbarkeit, Methotrexat-Toxizität, Lachgas-Toxizität, Zervixdysplasie, Anenzephalie, Gaumenspalte, Hypospadie, Spina bifida, Zungenbrecher
Final kann ich noch auf die eingangs genannten Funktionen für eine Anamnese verweisen. Grundsätzlich gilt aber: Bitte nicht verrückt machen – diese Seite hier ist nichts für Hypochonder, keiner fällt sofort um. Hier geht es um die Optimierung und Suche nach Ursachen… wobei sich ganz viel mit anderen Ursachen überschneiden kann.
Was tun? Der Weg der Ernährung & Supplemente bei unklarem MTHFR-Status
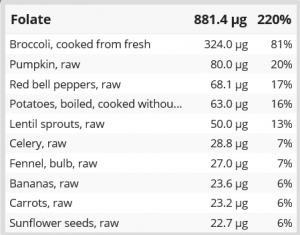
Die Quellen meiner Folsäure (Cronometer).
Dr. Ben Lynch [1] rät zu Vorsicht mit pauschalen hohen Dosen an 5-MTHF (Folat) im Multi-Milligrambereich, weil dieses vom Organismus nicht mehr ‘eingebremst’ werden kann und das Risiko einer Über- bzw. Hypermethylierung birgt (u.a. Nebenwirkungen wie wütend, unruhig, aggressiv, aber auch dass man geistig so flexibel ist, dass man sich zu leicht ablenken lässt und sich nur schwer konzentrieren kann). Wer mehr als 400-800 µg Folat-Äquivalente ergänzen möchte, seinen MTHFR-Gen Status aber nicht kennt, der könnte einen Teil des Folats (oder auch alles) mit Folinsäure (u.a. Metafolin) ergänzen, die nicht vollständig methyliert ist, aber auch eine hervorragende Bioverfügbarkeit von ca. 92% hat [13].
Die Supplementierung mit Folinsäure umgeht, wie auch L-5-MTH Folat, die Dekonjugations- und Reduktionsschritte, die bei Folsäure angewendet werden, wobei (synthetische) Folsäure niemals Menschen mit MTHFR gegeben werden sollte [6][9]. Aus [9] (deepl.com):
“Dies ist besonders wichtig bei Patienten, die die MTHFR-SNPs tragen. Bei diesen Patienten ist es zwingend erforderlich, das aktive 5-Methyl-THF-Derivat in einer Dosierung von 600-800 µg (pro Tag) zu verwenden, um das mutierte Enzym zu umgehen und den vollen Nutzen der Folsäure zu erhalten. Daher sollte der Ersatz von Folsäure durch 5-Methyl-THF in pränatalen Vitaminen unbedingt als universell vorteilhaft angesehen werden.”
Weiterhin ist es wichtig genug Glycin zu sich zu nehmen, als “Puffer” für überschüssige Methylgruppen [21]. Wenn zu viele Methylgruppen vorhanden oder zugeführt werden, wir jedoch wenig Glycin zu uns nehmen, besteht die Gefahr, dass unser Entgiftungssystem beeinträchtigen, unseren Blutzucker destabilisieren, unseren Schlaf stören, unsere Knochen schwächen und unsere Haut schneller altern lassen kann. Ungut. Insofern würde ich selber ruhig 1-3 g Glycin und/oder Kollagen (enthält ca. 30% Glycin) pro Tag zu mir nehmen.
Es muss jedoch nicht immer alles 5-MTHF sein oder immer dieses fehlen. So gibt es verschiedene Methyl-Donatoren und dann die (Co-) Faktoren, welche alle (neben anderen) für die Methylierung benötigt werden [19]:
- Methyl-Donatoren: SAMe, Methionin, TMG, Cholin, ggf. Methyl-Cobalamin (B12)
- Co-Faktoren: Magnesium, Folat(e), B12, B6(-P5P), B2, Zink sowie Vitamin A (Retinol) für die Produktion des Enzyms, das Glycin als “Methylpuffer” verwendet.
Beim B12 als Methyl-Cobalamin würde ich es bei Quecksilber-Belastung nicht übertreiben und ggf. zu Hydroxol-Cobalamin greifen. TMG finde ich sehr wichtig, es wird aber oft vergessen, wie auch das B2 (Riboflavin), was bei einem MTHFR-Problem sogar vermehrt benötigt wird [1]. Wer neurologische Probleme hat, könnte anstatt 5-MTHF ggf. auch auf die Folinsäure zurückgreifen, da diese wohl am besten die Blut-Gehirnschranke überwindet [13]. Einige empfehlen auch (direkt) mit SAMe zu ergänzen – wobei dieses sehr teuer ist, nicht allen fehlt und teils zu Nebenwirkungen führt [16]. Die Ergänzung von SAMe wäre für mich dann auch ein ‘letzter’ Schritt, wenn alles andere nicht (genug) greift. Das genug Zink und B6-P5P da sein muss – sollte sich für die Leser hier von selber verstehen 😉
Wer das Ganze mit guter Ernährung ergänzen möchte, der kann dieses unter anderem mit Brokkoli, Hülsenfrüchten & vielem (frischem) grünen Blattgemüse machen. Allerdings ‘zerfällt’ das Folat bei langer Lagerung und hoher Temperatur. Zudem braucht die Aufnahme von Nahrungs-Folat auch Zink & genug Magensäure. Magensäure fehlt bei vielen Menschen – was dann auch die Aufnahme anderer Mikronährstoffe & von B12 negativ beeinflusst. Für einen Überblick der Folat-Zufuhr durch die Nahrung nutzt Ihr am besten Cronometer – damit Ihr eine grobe Idee habt ob eure natürliche Folat-Zufuhr ausreichend ist.
Da bis zu 70% des SAMe in die Synthese von Kreatin ‘gehen’, ist es oft auch sinnvoll, Kreatin zu ergänzen – speziell wenn die Zufuhr von tierischen Fleischprodukten reduziert oder nicht vorhanden ist. 2-3 g am Tag sind das, was ich selber nutze. Etwas mehr Glycin kann auch helfen.
Wer exzessive Mengen von B3-Vorläufern wie Niacin, Nicotinamid (NAM), Nicotinamid Ribosid (NR) oder NMN einnimmt (z.B. > 250-500 mg / Tag), der sollte unbedingt darauf achten, dieses mit genug Methyl-Donatoren wie den hier besprochenen TMG, Folat (als 5-MTHF, Folinsäure), B12, B2, B6 & Co. auszugleichen, da sehr viel SAMe in die Regenerierung von NAD+ aus NAM bzw. die Ausscheidung von NAM über die Leber in den Urin verwendet bzw. verbraucht wird.
Ach ja: Dr. Ben Lynch weist noch darauf hin, dass erst einmal die B12-Spiegel gut sein müssen – bevor Methyl-Folat ergänzt wird [1]. Und ich weise darauf hin, dass auch Lithium o.k. sein muss, damit B12 gut funktioniert 😉
Was tun, speziell wenn Folat nicht ausreicht? Hinweise von Dr. Ben Lynch aus dem Buch ‘Schmutzige Gene’

Buch: Schmutzige Gene (Dirty Genes) von Dr. Ben Lynch
Lynch schreibt [1] das Eine Schilddrüsenunterfunktion (Hypothyreose) die Fähigkeit verlangsamt, Vitamin B2 zu aktivieren, so das eine Schilddrüsen-Unterfunktion abgeklärt werden sollte. Zudem sollte die Schilddrüsenfunktion unterstützt werden,
- indem Sie Stress reduzieren,
- Ihre Nebennieren unterstützen,
- Ihren Darm heilen,
- Chemikalien vermeiden,
- Ihr Wasser filtern,
- ausreichend schlafen und Infektionen bekämpfen.
Lynch verweist dann noch auf die Punkte und Tips, die er in Bezug auf eine mögliche Beeinträchtigung der DAO und des ggf. vorliegenden langsamen COMT gibt. In Bezug auf MTHFR schreibt er:
- Riboflavin / Vitamin B2: Dies ist ein Nährstoff, den MTHFR braucht, um richtig zu funktionieren.
- Die aktivste Form ist Riboflavin-5-Phosphat (R5P)
- H.C.: Wobei ich nicht davon ausgehe, das es nötig ist, das die Phosphat-Gruppe im Magen/Darm entfernt wird – vor der Aufnahme.
- Eine tägliche Dosis von 20 Milligramm ist für die meisten Menschen ausreichend; andere benötigen jedoch bis zu 400 Milligramm, insbesondere diejenigen, die mit Migräne zu kämpfen haben.
- Die aktivste Form ist Riboflavin-5-Phosphat (R5P)
- L-5-MTHF oder 6S-MTHF. Dies sind beides hochwertige Formen von Methylfolat.
- Viele Menschen kommen gut mit einem Multivitaminpräparat aus, das 400 µg MTHF enthält.
- Wenn Sie mit 400 Mikrogramm keine Veränderung spüren, versuchen Sie mehr. Machen Sie jedoch keinen großen Sprung; versuchen Sie, die Dosis zu verdoppeln.
- Viele Mediziner gehen direkt zu höheren Dosen von 7,5 mg oder mehr über. Dies mag zwar anfängliche Vorteile bringen, kann aber innerhalb weniger Tage erhebliche Nebenwirkungen verursachen.
- Eine andere Möglichkeit ist die Verwendung von liposomalem MTHF. Auf diese Weise können Sie die Dosis regulieren und das MTHF direkt in Ihre Zellen bringen.
Lynch schreibt auch: Wenn Sie 5 mg oder mehr Methylfolat einnehmen und keine Reaktion bemerken, könnte einer der folgenden Punkte der Grund sein:
- Sie haben Folsäure-Rezeptor-Antikörper und diese blockieren Ihre Folsäure-Rezeptoren. (Siehe Anhang A für mehr über Tests, die feststellen können, ob dies der Fall ist.)
- Sie nehmen noch Folsäure zu sich, und diese blockiert Ihre Rezeptoren.
- Sie haben einen Mangel an Vitamin B12, so dass Ihr Methylfolat gefangen ist und nicht genutzt werden kann.
- Sie verwenden ein minderwertiges Präparat, das D-Methylfolat anstelle von L-Methylfolat enthält. Wenn das Präparat keine Angaben zu L-Methylfolat oder 6S-Methylfolat enthält, kann es die minderwertige D-Methylfolat-Form enthalten. Ihr Körper kann D-Methylfolat nicht verwerten. Fragen Sie den Hersteller.
- Ihr Methylierungs-Zyklus ist aus anderen Gründen blockiert, z.B. durch Schwermetalle, oxidativen Stress, Infektionen oder Medikamente.
Vorsicht: Lynch schreibt: Wenn Sie Angstzustände, Reizbarkeit, eine laufende Nase, Gelenkschmerzen, Schlaflosigkeit oder Nesselsucht verspüren, nehmen Sie möglicherweise zu viel MTHF ein. Brechen Sie die Einnahme sofort ab und nehmen Sie alle zwanzig Minuten 50 mg Niacin ein, bis Ihre Nebenwirkungen verschwinden (maximal dreimal). Wenn Sie jedoch einen niedrigen Blutdruck von 90/60 oder weniger haben, seien Sie vorsichtig: Das Niacin könnte Ihren Blutdruck weiter senken.
Ein wichtiger Hinweis zum Unterschied der L-5-MTHF-Folat und Folinsäure (z.B. Metafolin)
In Teil 2 der Folat-Serie hatte ich schon auf die verschiedenen Folat-Varianten hingewiesen: L-5-MTHF und wie im letzten Abschnitt schon kurz angeführt: Folinsäure, welche u.a. als Levomefolinsäure (Levomefolic Acid) vermarktet wird und noch nicht vollständig methyliert ist. Das könnte ein Vorteil sein, wenn mehr Folat zugeführt wird, aber der MTHFR- & Co. Status doch noch nicht so ganz klar ist.
Der nächste kurze Abschnitt ist nur für eingeloggte Freunde des Blog lesbar.
Mein Fazit
Schon ein Wahnsinn, wie komplex so etwas einfaches wie die Folat-Arten (Teil 1 & Teil 2) und bzw. der Folat-Bedarf werden kann. Wo für ‘Normalos’ die 200-400 µg als Supplement in der Regel absolut ausreichend sein sollten – und bei guter Ernährung ggf. nicht einmal benötigt werden – haben die Menschen mit T677T bzw. den beiden ‘MTHFR-Gen’-Mischformen wohl schon einen klaren genetischen Nachteil, wobei die gesamte Thematik, in Bezug auf Walsh, natürlich komplexer ist. Deswegen sollte nicht nur auf die Gene, sondern insbesondere auf die Symptome und Blutwerte geschaut werden.
Bei einer einfachen Einschränkung würde ich aktuell, nach Gefühl, die 400 µg 5-MTHF + ggf. 400 µg Folinsäure / Tag zuführen. Wer von einem T677T Polymorphismus betroffen ist, bzw. von der Mischformen beider Gene, der braucht ggf. 800 µg 5-MTHF + ggf. extra Folinsäure. Zu stark würde ich es jedoch erst einmal nicht übertreiben, denn eine Über- bzw. Hyper-Methylierung ist auch nicht gut, weswegen ich bei mehr als 800 µg Folat als ‘Extra’ eher zu der noch nicht methylierten Folinsäure greifen würde.
Insofern ist eine gute Ernährung schon einmal die Grundlage von allem. Im zweiten Punkt sollten Belastungen mit Giftstoffen, Stress, Alkohol, Rauchen und vielen Medikamenten & Co. vermieden werden und im dritten, oder sogar allerersten, Schritt eine Ergänzung mit Folat (als L-5-MTHF oder Folinsäure), B2, B6-P5P, B12, TMG, ggf. auch Glycin und Kreatin und in jedem Fall immer Magnesium (meinem #1 Supplement) erwogen werden. Die Rolle von Magnesium und B2 wird einfach zu stark unterschätzt, denn sehr viel Menschen (>50%?) sind im Mangel bei beiden. Glycin wird generell unterschätzt und kann auch in hohen mengen > 5g / Tag faktisch nicht schaden, jedoch viel nützen.
Ach ja: Bei der Ergänzung von SAMe bin ich selber recht unentschlossen – und würde dieses, im Regelfall, erst einmal ‘hinten’ anstellen. SAMe ist für mich nur eine (teure) Option wenn andere Interventionen nicht greifen.
Welche Supplemente nutze ich bzw. würde ich nutzen?
Folgende Supplemente nutze ich alle bzw. habe ich genutzt:
- 5-MTHF-Folat
- Dr. Best (400 µg, 90 Stück, Folat aus Quatrefolic®️, (6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz) – ohne Siliziumdioxid
- Dr. Best (800 µg, 60 Stück, Folat aus Quatrefolic®️, (6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz) – ohne Siliziumdioxid
- Jarrows (400 µg, Folat aus Quatrefolic®️, (6S)-5-Methyltetrahydrofolsäure, Glucosaminsalz) – ohne Siliziumdioxid
- NOW (1000 µg, Tabletten) – Teilbar, ökonomische Variante, wenn man diese Tabletten teilt.
- Folinsäure
- Source Naturals (800 µg, Tablette) – leider mit Siliciumdioxid
- Vitamin B2
- Nature’s Way (100 mg, 100 Kapseln) – ohne Siliziumdioxid
- Vitamin B12
Aktuell würde ich wieder zu Jarrows bzw. Dr. Best greifen – je nach Verfügbarkeit. NOW ist interessant wegen dem Preis, wenn man die Tabletten teilt, und die Folinsäure ist gut, wenn man nicht weiß ob eine MTHFR-Störung vorliegt, man jedoch zur Sicherheit etwas höher dosieren mag.
Ach ja: Wenn Ihr bei iHerb etwas bestellen solltet, dann gebt bitte den 5% Rabatt-Code “HER2060“ an – und tut mir damit einen kleinen Gefallen.
Zusatz: Der Methylierungs-Zyklus nach Yasko – mit Co-Faktoren, Genen, SNP’s
Der nächste kurze Abschnitt ist nur für eingeloggte Freunde des Blog lesbar.
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare