Alpha-Liponsäure Teil 2: Pharmakologische Halbwertzeiten von RS-ALA, (Na-) R-ALA, DHLA, Interaktionen mit Quecksilber (Hg) und das Cutler-Protokoll
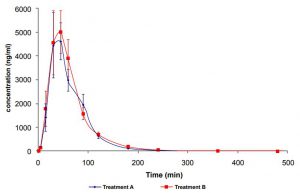
Konzentrations-/Zeitkurven für zwei Formulierungen der Alpha-Liponsäure (600mg, Gelkapsel A, Tablette B). Quelle: [18], Lizenz CC BY SA
Warum ist mir das Thema wichtig? Wenn man A. Hall Cutlers Überlegungen zur Schwermetall-Ausleitung und der sicheren Verwendung von Alpha-Liponsäure bei unklarem Status in Bezug auf Quecksilber folgt, dann ist das relevant. Cutler basierte seine Überlegungen darauf, das die Alpha-Liponsäure, bzw. ihre reduzierte Form, das DHLA, ein Schwermetall-Chelator für anorganisches Quecksilber (Hg2+) ist. Inzwischen haben auch andere Forscher belegt, das dies so ist – allerdings bisher nur in der Petrischale und (noch) nicht im Menschen. Im Mensch muss der DHLA-Hg-Komplex ja auch noch irgendwie über Stuhl (-> Leber, Galle, Darm) und / oder Urin (-> Niere) ausgeschieden werden und erst einmal aus der Zelle über das Blut dorthin gelangen – ein komplexer Prozess, den viele Menschen (u.a. auch Therapeuten) vergessen oder zu stark vereinfachen.
Wenn nun DHLA wirklich Quecksilber ‘cheliert’ (also wie z.B. DMPS und DMSA), dann müsste, folgt man Cutler, auch ALA recht zwingend im Rahmen der Halbwertzeit (ca. 2h, ggf. 3h) zugeführt werden – wie es Cutler im Jahre 1999 [2] beschrieben hatte. Wer dies nicht macht – der kann sich aus meiner Sicht schon kurz oder mittelfristig, ggf. irreversibel, schaden.
In diesem Artikel geht es mir nun um eine ‘Tiefenbohrung’, in der ich Cutlers Überlegungen aus den 90’er Jahren des letzten Jahrhunderts nachvollziehen möchte. Dazu betrachte ich folgendes:
- Grundsätzliches zu den Halbwertzeiten von RS-ALA, R-ALA, Na-R-ALA und S-ALA
- Anstieg von ALA im Serum und zwei seiner seiner Metaboliten (Nüchtern, spätere Mahlzeit)
- Anstieg von R- und S-ALA im Serum mit oder ohne Nahrungsaufnahme nach Gabe von RS-ALA
- RS-ALA im Serum im Vergleich verschiedener Formulierungen (Tablette, Cellulose- und Gelantinekapsel)
- RS-ALA im Serum im Vergleich verschiedener Formulierungen (Softgel und Tablette)
- R-ALA und Na-R-ALA in Vergleich (Carlson et al.+ Geronova)
- Vergleich zwischen R- und RS-ALA bei jungen und altem Menschen, Männer & Frauen
- Vergleich zwischen RS-ALA (600 mg) und R-ALA (200 & 300 mg) als Tablette in gesunden koreanischen Männern
- Vergleich zwischen Infusionen und oraler Gabe von RS-ALA – Wahnsinn!
- Ergänzungen zu Halbwertzeiten von ALA, Bioverfügbarkeit & Co.
- Halbwertzeiten von DHLA (dem reduzierten ALA) im Plasma – Nichts genaues…
- Zusammenfassung der betrachteten Studien zu ALA (Art, Dosis, Cmax, tmax, t1/2)
- Cutler, RS-ALA und die anderen Varianten, die Halbwertzeit, Quecksilber und das Cutler-Protokoll
Zum Ende des Artikels folgt wie üblich mein Fazit.
Hinweis: Hier geht es zu Teil 1 der ALA-Serie. Und hier zum Nachschlag:
- Teil 3: Ist ALA ein effektiver intrazellulärer Quecksilber-Chelator oder nicht? Cutler und / oder Shade?
- Teil 4: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Die Zerlegung der wichtigsten Studien: Gregus, Leskova, Grunert, Chekmeneva, Hossain und Bjørklund
- Teil 5: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Cutler vs. Shade – die Perspektive von R. Rust Lee und mein Fazit
Inhaltsverzeichnis für den Schnellzugriff
Grundsätzliches zu den Halbwertzeiten von RS-ALA, R-ALA, Na-R-ALA und S-ALA
Bei den Halbwertzeiten findet sich ein ziemlich breites Spektrum an Angaben in den Studien. Teilweise passten dann auch die Textangaben nicht zu den Grafiken und die Bezugsgrößen bzw. Definitionen sind anders belegt. Deswegen hier zur Übersicht die Definition, welche ich nachfolgend verwende um die Daten der einzelnen Studien vergleichbar zu machen:
- Cmax = Höchster Wert (von ALA) der im Serum/Plasma erreicht wird.
- tmax = Zeit ab der Einnahme bis zum Höchstwert (Cmax) im Serum / Plasma
- t1/2(rel) = Zeit vom tmax bis zum halben Cmax Wert in der abfallenden Kurve
- t1/2(abs) = Zeit von der (oralen) Einnahme bis zum halben Cmax Wert in der abfallenden Kurve
Speziell die Halbwertzeiten der verschiedenen ALA-Varianten bzw. von RS-ALA sind mir im Hinblick auf das Cutler-Protokoll zur intrazellulären Quecksilber-Ausleitung sehr wichtig. Mehr dazu gegen Ende des Artikels.
Anstieg von ALA im Serum und zwei seiner seiner Metaboliten (Nüchtern, spätere Mahlzeit)
Die nachfolgenden Zeilen sind aus vielfältigen Gründen nur für im Blog eingeloggte Wesen zu lesen.
RS-ALA im Serum im Vergleich verschiedener Formulierungen (Softgel und Tablette)

Konzentrations-/Zeitkurven für zwei Formulierungen der Alpha-Liponsäure (600 mg, Gelkapsel A, Tablette B). Quelle: [18]. Lizenz: CC BY SA.
- a) 2* Softgel/Weichkapsel: 300 mg (patentiertes) RS-ALA, mehrfach 180 mg ungesättigte Fettsäuren (Linolsäure, α-Linolensäure) und andere (Vitamine, Spurenlemenete, Hilfsstoffe).
- b) 1 * Tablette: 600 mg (patentiertes) RS-ALA und andere (Vitamine, Spurenlemenete, Hilfsstoffe).
Die Autoren schreiben u.a., das orale Formulierungen von α-Liponsäure aufgrund der Eigenschaften des Moleküls (kurze Halbwertszeit im Blut, hohe präsystemische Elimination und hepatischer First-Pass-Effekt) und der Eigenschaften der Darreichungsformen problematisch sind . etwa, was ich auch in Teil 1 zu ALA beschrieben hatte. Folgende Werte wurden dann ermittelt:
- Tabletten: Hier ist der Cmax Serum deutlich niedriger als beim Rest (ca. 2,5 µg/ml).
- Cmax = 6.66 ± 1.17 µg/ml
- tmax = 45.0 ± 4.4 min
- t1/2(rel) = 46.2 ± 15.1 min
- t1/2(abs) = ca. 90 m.
- Softgel: Diese verzögern etwas die Freisetzung des ALA um ca. 25 Minuten gegenüber den Cellulosekapseln.
- Cmax = 7.00 ± 1.32 µg/ml
- tmax = 51.8 ± 4.3 min.
- t1/2(rel) = 40.1 +/-17.1 min
- t1/2(abs) = ca. 90 min.
Interessant ist hier, das sich die Tabletten nicht von den Softgels unterscheiden und so ein anderes Bild darbieten als die vorgenannte Studie [17]. Allerdings ist zu bedenken, das auch Tabletten so produziert werden könne, das diese sich schnell auflösen. So führte denn auch das Softgel zu leicht höheren Anstiegen im Plasma, wobei die andere Studie ALA im Serum gemessen hatte. Ob dieses die Messung beeinflusst weis ich nicht. Interessant ist jedoch, das sich die erreichten Blutwerte (Cmax) nicht stark von denen in der vorgenannten Studie [17] unterscheiden. Insofern bleibt unklar, ob die patentierte Form irgendwelche Verbesserungen bietet.
R-ALA und Na-R-ALA in Vergleich (Carlson et al.+ Geronova)
Die nachfolgenden Zeilen sind aus vielfältigen Gründen nur für im Blog eingeloggte Wesen zu lesen.
Ergänzungen zu Halbwertzeiten von ALA, Bioverfügbarkeit & Co. + Time-Release ALA
Salehi et al. (2019) [19] ergänzen in Bezug auf ALA-Absorption und Plasmakonzentrationen, das orale Dosen von 50-600 mg RS-ALA schnell absorbiert werden. Die Zeit, die benötigt wird, um die maximalen Plasmakonzentrationen (tmax) zu erreichen, beträgt in der Regel etwa 0,5 bis 1 h. Außerdem wurde festgestellt, dass die maximalen Plasmakonzentrationen des R-Enantiomers 40 bis 50 Prozent höher waren als die des S-Enantiomers.
Carlson et al. [9] merken zu teils vermarkteten ‘Time-Release’ ALA-Produkten an, das dort teils behauptet wird, das die therapeutische Wirksamkeit von ALA aufgrund der relativ kurzen Zeitspanne, in der therapeutische Plasmakonzentrationen aufrechterhalten werden können, begrenzt ist. Allerdings zeigt die klinische Forschung, dass gerade der schnelle und steile Anstieg der Serum bzw. Plasma-Konzentrationen (-> hohes Cmax) für die grundlegenden physiologische und metabolischen Eigenschaften von ALA verantwortlich ist (und eben kein Mangel). So schreiben die Autoren dann auch:
“Alle PK (Anm. pharmakokinetische) Studien der letzten 57 Jahre liefern unwiderlegbare Beweise, dass QRLA (Quick-Release ALA) sicher und wirksam ist. Die jüngsten Versuche, CRLA (Continuos Release ALA) als eine überlegene Form von LA zu vermarkten, sind technisch unbegründet. Basierend auf dem, was über die grundlegenden Wirkmechanismen von LA bekannt ist, ist es zweifelhaft, dass CRLA in vivo jemals in der Lage sein wird, QRLA zu ersetzen oder mit ihm zu konkurrieren. “
Diese Position wird zusätzlich durch die Tatsache gestärkt, dass es bisher keine positive Korrelation zwischen der Konzentration im Plasma und der Pharmakodynamik (PD) von LA gegeben hat. Dies deutet darauf hin, dass
- die positiven Effekte von LA schnell induziert werden,
- nicht von der mittleren Verweilzeit (MRT) im Plasma abhängen und
- eine Schwellenkonzentration erfordern, die mit den aktuellen CRLA-Produkten nicht erreicht werden kann.
Das ganze hat schlussendlich mit der Aktivierung bzw. Induktion von Nrf2 zu tun.
Halbwertzeiten von DHLA (dem reduzierten ALA) im Plasma – Nichts genaues…
In meinem ersten Artikel schrieb ich, das in vielen Fällen die reduzierte Version von ALA, das DHLA, die Form ist, die für viele wesentliche Effekte von ALA sorgt – u.a. wohl auch die potentielle Chelierung von Quecksilber. Ich habe viel nach Studien bezüglich der Halbwertzeit von DHLA im Blut gesucht – und wurde nicht ‘so richtg’ fündig.
Das LPI [5] merkt an, das ALA denn auch rasch zu Dihydroliponsäure reduziert wird und In-vitro-Studien darauf hinweisen, dass DHLA dann rasch aus den Zellen exportiert wird. Das Problem ist zudem, das mehrere empfindliche Assays nicht in der Lage sind, selbst geringe Mengen von DHLA im Plasma nachzuweisen [15], u.a. wegen
- der kurze Plasmahalbwertszeit von ALA,
- der schnelle Umwandlung von ALA in fünf (bzw. 6 [10]) primäre Metaboliten [15]:
- u.a. DHLA
- BMOA: 6,8-Bis(methylthio)octansäure
- BNLA: BisnorLA oder 3-(1,2-Dithiolan-3-yl)-propansäure
- BMHA: 4,6-Bis(methylthio)hexansäure
- TNLA: Tetranorliponsäure
- BMBA: 2,4-Bis(methylthio)butansäure
- KLA: 3-ketolipoic acid [10]
- die fehlende Akkumulation der Ausgangsverbindung oder ihrer Metaboliten, sowie
- die kurzen Halbwertzeit (durch S-Methylierung des Dithiolanrings).
Zudem sind wässrige Lösungen von DHLA stabiler als DHLA im (Blut-)Plasma, da DHLA die Plasmakomponenten schneller reduziert als es durch (gelöste) Luft oxidiert wird. Im Menschen ist DHLA zudem aufgrund seiner schnellen Seitenkettenoxidation und S,S-Dimethylierung nur schwer nachweisbar. [15]
Zusammenfassung der betrachteten Studien zu ALA (Art, Dosis, Cmax, tmax, t1/2)
In der nachfolgenden Tabelle habe ich die Daten aus den vorgestellten Studien einmal ‘übersichtlich’ zusammengefasst. Das Bild ist aus meiner Sicht durchaus unübersichtlich, in dem Aspekt, das die Cmax Werte der ALA-Formen verschiedenen Studien auch bei gleichen Dosierungen und Rahmenparametern (u.a. nüchterne Einnahme, gleiche Dosis) sehr unterschiedlich ausfallen. Keith at al. [19] geben einen kleinen Vorgeschmack, warum das so sein kann: Unterschiede zwischen Mann und Frau und den Alterskohorten (jung/alt). Gleiter et al. [4] machen dann klar, das eine Mahlzeit vor der Einnahme von R-ALA die pharmakokinetischen Parameter stark beeinflusst. Hier dann die Tabelle:
| Studie | ALA-Art | Dosis mg | Cmax µg/ml | tmax min. | t(rel) min. | t(abs) min. |
|---|---|---|---|---|---|---|
| Biewenga et al. [10] | R?-ALA (Essen nach 80 min.) | 1000 | 2,2 | 100 | 50 | 150 |
| Gleiter et al. [4] | R-ALA (nüchtern) | 600 | 2,2 | 20 | 70 | 90 |
| R-ALA (Frühstück) | 600 | 0,75 | 60 | 105 | 185 | |
| Yadavet et al. [17] | RS-ALA Tablette | 600 | 3,81 | 94,3 | 81,2 | 170-180 |
| RS-ALA Gelatine | 600 | 9,98 | 71,3 | 40,1 | 120-130 | |
| RS-ALA Kapsel | 600 | 10,28 | 78,3 | 35,7 | ~110 | |
| Mignini et al. (2012) [18] | RS ALA Softgel | 600 | 6,66 | 45,0 | 46,2 | ~90 |
| RS-ALA Tablette | 600 | 7,00 | 51,8 | 40,1 | ~90 | |
| Carlson et al. (2008) [15] | Na-R-ALA (m/f) | 600 | 14,1/18,1 | 10/15 | 13/12 | 24/27,5 |
| R-ALA (m/f) | 600 | 0,7/1,01 | 25-30 | – | ~40 | |
| Carlson et al. [8] | Na-R-ALA | 600 | ~15 | ~15 | ~15 | ~30 |
| Keith et al. (2012) [19] | R-ALA (jung/alt) | 500 | 1,5/3,2 | 36,1/35,3 | – | 39/70 |
| Na-R-ALA (jung/alt) | 500 | 2,5/2,55 | 42,5/35,3 | – | 47/67 | |
| Yoon et al. [20] | R-ALA | 200 | ~3,8 | ~20 | – | ~42 |
| R-ALA | 300 | ~6,4 | ~20 | – | ~42 | |
| RS-ALA | 600 | ~4,8 | ~20 | – | ~48 | |
| Patel et al. [3] | RS-ALA Oral | 600 | ~0,7 | ~20 | – | ~110 |
| RS-ALA Infusion | 200 | ~7 | ~17 | – | 22,2 | |
| RS-ALA Infusion | 600 | ~27,5 | ~20 | – | ~30 |
Nach meiner subjektiv ‘objektiven’ Auswertung sind sind für mich folgende Dinge au der Tabelle und den verlinkten Studien zu erkennen:
- Die Cmax-Reihenfolge (höchste Anstiege im Serum/Plasma) ist:
- 1. Infusion (RS-ALA) mit extremen Spitzen,
- 2. Na-R-ALA mit noch sehr hohen Cmax,
- 3. mit Abstand R-ALA und
- 4. RS-ALA
- Die t1/2 (abs) Reihenfolge ist:
- 1. Infusion,
- 2. Na-R-ALA (knapp dahinter),
- 3. mit Abstand R-ALA und
- 4. dann RS-ALA mit der längsten Halbwertzeit.
- Jüngere Menschen metabolisieren Na-R & R-ALA schneller als ältere.
- Eine Mahlzeit vor oder während der Einnahme von ALA senkt das Cmax und verlängert t1/2.
Die Halbwertzeiten der ALA Formen bewegten sich im Bereich:
- RS-ALA: 90-180 min., mit einem Ausreißer von ~ 48 min [20], der mir nicht plausibel erscheint.
- R-ALA: 40-90 min.
- Na-R-ALA: 24-47 min., bei alten Menschen auch ~ 67 min [19]
- Infusion RS-ALA: 22-30 min.
Wie mag ich das alles bewerten? Pharmakokinetik ist eine extrem komplexe Sache die von wahnsinnig vielen Parametern abhängt. Zu wenig Magensäure? Etwas gegessen? Darmfunktion, Formulierung der Kapsel oder Tablette, Zusatz- und Füllstoffe, Alter & Form von ALA. In jedem Fall aber passt die Halbwertzeit von RS-ALA grob zu dem Zeitfenster, das auch Cutler für sein Protokoll zur Quecksilber-Ausleitung angibt: 120-180 Minuten bzw. 2-3 h.
In [AC5] schreibt Cutler dann selber kurz, dass die Kinetik von ALA ist viel komplizierter ist, jedoch mit einer Halbwertszeit von 1,5 bis 2,5 Stunden (was zu meinen Daten passt) hinreichend beschrieben wird. Die Spitzen verteilen oder “verschmieren” sich nach Cutler [AC5] über einen Zeitraum von 2 Stunden, weil es etwa 2 Stunden dauert, bis ‘das Zeug’ langsam absorbiert wird, wenn oral eingenommen. Wie lange man nun EXAKT zwischen den Dosen warten sollte, variiert von Individuum zu Individuum. Cutlers Angaben beziehen sich hier auf die Rückmeldung von vielen Menschen, die sein Protokoll angewendet haben.
Cutler, RS-ALA und die anderen Varianten, die Halbwertzeit, Quecksilber und das Cutler-Protokoll
In Bezug auf das Cutler-Protokoll besteht immer wieder die Frage ob nicht auch R-ALA oder Na-R-ALA anstatt RS-ALA verwendet werden können. Cutler beantwortete die Frage mehrfach. Hier eine der Antworten [AC1] (deepl.com):
“Alle relevanten Erfahrungen, bei denen es Menschen besser ging, waren mit der regulären reinen (RS-)ALA. Alle relevanten Publikation sind über die einfache RS-ALA (Anm.: Stand ca. 2005). Warum sollten Sie sich in ein originelles Forschungsprojekt verwandeln, anstatt einfach das zu tun, was nötig ist, um gesund zu werden, nämlich reguläre Alpha-Liponsäure zu nehmen?”
In einem anderen Beitrag schrieb Cutler [AC3] noch, das R-ALA viel teurer sei als RS-ALA und man einfach nur die doppelte Menge von RS-ALA anstatt R-ALA zu sich nehmen müsste und die S-ALA Form nicht störe. Zudem sein alle relevanten Chelatierungsstudien in der Literatur mit RS-ALA durchgeführt worden (u.a. Gregus, Leskova), und alle Menschen, die bereits mit ALA und dem Cutler-Protokoll genesen sind bzw. Ihre Hg-Symptome mildern konnten, taten dies mit RS-ALA. Aus meiner Sicht besteht das Problem der anderen ALA-Formen denn auch primär in Bezug auf die klar kürzeren Halbwertzeiten (t1/2).
Cutler merkt auch an, das ALA/DHLA zwar das GSH in den Zellen erhöhe, weil es oxidativen Stress senke, und über das DHLA-Redoxpaar auch GSH regenerieren könne – GSH alleine jedoch kein Hg aus den Zellen entferne. ALA erhöhe nach Cutler zwar dramatisch die Ausscheidung von GSH-Hg-Komplexen mit der Galle aus der Leber, wie es auch Shade sagt, aber GSH exportiere das Hg nicht zwangsweigerlich aus den Zellen (irgendwo im Körper oder Gehirn) [AC4]:
“While mercury is excreted in the bile bound to glutathione, binding it to glutathione does not remove it from cells generally.”
Hingegen sei der Quecksilberionen-Dihydrolipoat-Komplex (Hg-DHLA) ladungsmäßig neutral oder an der Carboxylatgruppe, leicht protoniert und somit lipidlöslich. So könne der DHLA-Hg-Komplex leicht durch Zellmembranen hindurchgehen (Anm.: Mein Verständnis: Ohne aktiven enzymatischen Transporter). Auf diese Weise kann (nach Cutler) ALA (über das Zwischenprodukt DHLA, was vom Körper auf natürliche Weise aus ALA hergestellt wird) das Hg innerhalb der Zellen chelatieren und es aus den Zellen hinaus befördern. Anmerken mag ich hier, das Chris Shade die Studien anders interpretiert [11][12] – Stoff für den 3ten Teil der ALA-Serie. Leicht ‘Ketzerisch’ mag ich hier noch kurz Frau Lee, Co-Autorin des letzten Buches von Cutler aus 2019 [1] zitieren [6]:
“Chris Shade hat die Gregus-Studie (Anm: [7]) fehlinterpretiert. Er hat einen finanziellen Anreiz, die Darstellung zu kontrollieren und den Verkauf der teuren Produkte von Quicksilver zu fördern. Er weiß auch, dass die meisten Leute (Ärzte und Zahnärzte eingeschlossen) keine Zeit haben, Papiere zu überprüfen. Und wenn sie es doch tun, haben sie ohne den entsprechenden Hintergrund möglicherweise Schwierigkeiten, die Studien zu verstehen und zu interpretieren. Vielleicht versteht Shade diese Studien nicht einmal selbst.”
So stellt Cutler fest, das andere Antioxidantien nicht zu den tiefgreifenden und dauerhaften Reduzierungen der Symptome bei Hg-Toxizität wie bei ALA führen. Ich mag anmerken, das dies wohl auch andere Nrf2-Aktivatoren (u.a. Brokkoli-Extrakte, EGCG) nicht bewerkstelligen, die ebenfalls GSH & Co. erhöhen. Da die Veränderungen nach Beendigung der ALA-Therapie (im Sinne des Cutler-Protokolls) bestehen bleiben, müssen diese (nach Cutler) auf eine dauerhafte Veränderung der Körperchemie (-> weniger Schwermetalle) zurückzuführen sein [AC2]. Ich werde dieses als weiteres Argument von Cutler, das ALA ein Chelator und nicht nur ein Nrf2-Induktor ist.
Auch Asket [13], der viele andre Wege der Schwermetallmobiliserung ausprobiert hat, schreibt, das ALA in erster Linie ein mobilisierendes Mittel für Hg sei und deswegen nicht zu Beginn einer Hg-Ausleitung oder Entgiftung eingenommen werden sollte, sondern in der zweiten Hälfte eines Chelatbildungsprogramms und idealerweise in Verbindung mit einem anderen (effektiven) Chelatbildner, um die Schwermetalle zu binden, die aus dem Blut und den Geweben mobilisiert/ausgeleitet werden sollen. Selber nutzte er auch R-ALA, wobei er darauf hinweist mit geringen Dosen anzufangen und langsam zu steigern. Ich mag hier anmerken, das in diesem Falle ggf. gleich das Cutler-Protokoll genutzt wird um Nebenwirkungen zu minimieren.
Mein Fazit
Die Recherche für diesen Artikel war ein riesiges Stück Arbeit, bei der selbstgestellten Aufgabe Cutlers Beweggründe und Schlussfolgerungen zur Pharmakokinetik von ALA nachzuvollziehen. Dabei muss bedacht werden, das Cutler dieses in der Mitte der 90er Jahre gemacht hatte. Wer auf die Daten meiner Studien schaut, der wird sehen, dass die meisten nach dem Jahr 2000 veröffentlicht wurden.
Wenn Cutler angibt, dass eine Einnahme-Intervall von RS-ALA im Bereich von 4 h schon kritisch ist, ein Intervall von 2-3h optimal in Bezug auf Seiteneffekte und Nebenwirkungen sei – dann muss es irgend einen plausiblen Zusammenhang zwischen dem was ALA macht und dem Hg im Körper geben.
C. Shade (PhD), welcher der Ansicht ist, das ALA kein Chelator sei, sondern primär Nrf2 hochreguliere, erwähnte einmal, das Nrf2 selber zwar eine kurze Halbwertzeit (<30 Minuten) hat – die dadurch hochgeregelten antioxidativen Systeme jedoch bis zu 10 Tage (in Ratten) über wiederholende Nrf2-Induktionen immer weiter hochgeregelt werden können. Wenn ALA nun, wie Shade es erklärt, primär über Nrf2 wirken würde, selber kein Quecksilber ‘verschiebt’ und alles was Quecksilber (Hg) betrifft über die Glutathion (GSH) geschieht, dann kann aus meiner Sicht etwas an dieser Erklärung nicht stimmen oder ist unvollständig. Wie jedoch im ersten Teil meiner ALA-Serie schon dargelegt macht ALA mehr als nur Nrf2 zu induzieren. Ob Shade seinen Kunden mit R-ALA letztendlich einen Gefallen tun ist eine andere, noch offene, Frage – welche ich in einer weiteren 3-teiligen Serie zu ALA, Culter & Shade nachgehen mag. Eines vorab: Shade hat einen massiv validen Punkt: Bindemittel für den Darm – etwas was ich als Cutler’s blinden Fleck ansehe. Denn wenn die DHLA-Hg-Komplexe eine Halbwertszeit von ca. 3h haben, dann ist es sinnvoll etwas im Darm zu haben, das diese Komplexe nach dem Zerfall “aufmoppt”. Welches Bindemittel dieses ggf. am effektivsten macht ist auch Teil eines zukünftigen Artikels & die Auflösung wird ggf. viele Menschen überraschen.
Für mich mehren sich so denn auch die Gründe die (empirisch) darlegen bzw. begründen, das ALA ein (effektiver) Metall- und Hg-Chelator ist. Mehr zum Thema dann in Teil 1, 2 und 3 meiner zweiten Serie zu ALA – eine die sich mit den Perspektiven von Cutler & Shade sowie den wichtigsten Studien zu ALA und Quecksilber befasst.
Links / Quellen
- [1] The Mercury Detoxification Manual: A Guide to Mercury Chelation, Rebecca Rust Lee and Andrew Hall Cutler, PhD, PE, 2019, ISBN 978-0-9676168-4-1
- [2] Amalgam Illness: Diagnosis & Treatment: What You Can Do to Get Better, How Your Doctor Can Help You, Andrew Hall, Ph.D. Cutler , 1. Juni 1999
- [3] Lipoic Acid: Energy Production, Antioxidant Activity and Health Effects (Oxidative Stress and Disease), Mulchand S. Patel, Lester Packer, CRC Press, Year: 2008, ISBN: 1420045377
- [4] Influence of food intake on the bioavailability of thioctic acid enantiomers, C H Gleiter et al., Clinical Trial Eur J Clin Pharmacol, 1996;50(6):513-4. doi: 10.1007/s002280050151.
- [5] Lipoic Acid, Linus Pauling Institute (LPI)
- [6] Episode Three of “The Chelation Wars”. What exactly is Lipoic Acid, Rebecca Lee, 5.4.2020
- [7] Effect of lipoic acid on biliary excretion of glutathione and metals., Gregus Z, Stein AF, Varga F, Klaassen CD, Department of Pharmacology, University Medical School of Pecs, Hungary., Toxicol Appl Pharmacol 1992 May;114(1):88-96, doi: 10.1016/0041-008x(92)90100-7
- [8] The Plasma Pharmacokinetics of R-(+)-Lipoic Acid Administered as Sodium R-(+)-Lipoate to Healthy Human Subjects., David A. Carlson; Anthony R. Smith, PhD; Sarah J. Fischer; Karyn L. Young; Lester Packer, PhD, Alternative Medicine Review Volume 12, Number 4 2007
- [9] The case against controlled release lipoic acid: A pharmacokinetic-mechanistic argument (part 1), David A Carlson, Anthony R Smith, Ph.D, Heinz Ulrich, M.D.
- [10] The pharmacology of the antioxidant lipoic acid, Gerreke Ph.Biewenga et al., General Pharmacology: The Vascular System, Volume 29, Issue 3, September 1997, Pages 315-331, doi: 10.1016/S0306-3623(96)00474-0
- [11] Dr Shade’s Lecture at ACIM 2017, Quicksilver Scientific, Dec 8, 2017
- [12] Dr. Christopher Shade Interview on Heavy Metal Detoxification for Autism, Becky Davila, 05.12.2019
- [13] Detoxification Protocols, Medical Insider
- [14] Lipoic acid and dihydrolipoic acid. A comprehensive theoretical study of their antioxidant activity supported by available experimental kinetic data., Castañeda-Arriaga R1, Alvarez-Idaboy JR., J Chem Inf Model. 2014 Jun 23;54(6):1642-52. doi: 10.1021/ci500213p. Epub 2014 Jun 10.
- [15] An evaluation of the stability and plasma pharmacokinetics of R-lipoic acid (RLA) and R-dihydrolipoic acid (R-DHLA) dosage forms in human plasma from healthy volunteers., Carlson, D.A. & Young, K.L. & Fischer, S.J. & Ulrich, Heinz. (2008), doi: 235-270. 10.1201/9781420045390.ch10.
- [16] Insights on the Use of α-Lipoic Acid for Therapeutic Purposes, Bahare Salehi et al., Biomolecules. 2019 Aug; 9(8): 356., Published online 2019 Aug 9. doi: 10.3390/biom9080356
- [17] Pharmacokinetic study of lipoic acid in multiple sclerosis: Comparing mice and human pharmacokinetic parameters, Vijayshree Yadav, MD et al., Mult Scler. 2010 Apr; 16(4): 387–397., Published online 2010 Feb 11. doi: 10.1177/1352458509359722
- [18] Human Bioavailability and Pharmacokinetic Profile of Different Formulations Delivering Alpha Lipoic Acid, Fiorenzo Mignini, Open Access, Medicine, Published 2012, DOI: 10.4172/scientificreports.418 (PDF)
- [19] Age and gender dependent bioavailability of R- and R,S-α-lipoic acid: A pilot study, Dove J. Keith et al., Pharmacol Res. 2012 Sep; 66(3): 199–206., Published online 2012 May 16. doi: 10.1016/j.phrs.2012.05.002
- [20] Comparison of R(+)-α-lipoic acid exposure after R(+)-α-lipoic acid 200 mg and 300 mg and thioctic acid 600 mg in healthy Korean male subjects, Jangsoo Yoon et al., Transl Clin Pharmacol, 2016, doi: 10.12793/tcp.2016.24.3.137
Konversationen von Andy Hall Cutler
- [AC1] Why I suggest not using R-ALA, Andy Cutler, Wed, 28 Jul 2004
- [AC2] Re: ALA as a chelator, AndyCutler, Date: Tue, 17 Apr 2001
- [AC3] Re: R-Lipoic Acid/Carnosine/Histidine, AndyCutler, Thu, 14 Nov 2002
- [AC4] Response to Dr. Boyd Haley’s response to my discussions of OSR, Andy Cutler, Wed, 20 Jan 2010
- [AC5] Andy protocol vs. DAN! protocol, does the difference matter?, Andy Cutler, Sun, 21 Jul 2002
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare