Liposomale Nahrungsergänzungsmittel & Vitamin C: Grundlagen (SUV, LUV, MLV), Vorteile, Aufnahme, Herstellungsverfahren, Rezepturen, Zeta-Potential & Co.
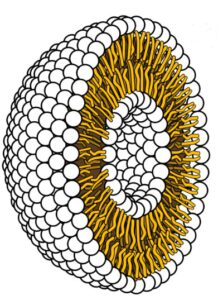
Liposom. Quelle: Wikipedia. Lizenz: Gemeinfrei
Liposomale Nahrungsergänzungsmittel (NEM) kennen viele ggf. vom liposomalem Vitamin C. Kurzum geht es bei ‘liposomal’ darum, den Inhalt (z.B. Vitamin C) nicht nur in den Körper oder das Blut, sondern direkt, und ohne viel “wenn und aber”, in die Zelle zu bekommen – etwas, was nicht mal die Infusion leistet!
Eine (teils) kontroverse Thematik bei Vitamin C ist z.B. die Aufnahme vom Darm in das Blut. Gerade die sogenannten ‘gepufferten’ Varianten von Vitamin C (u.a. Natrium-Ascorbat -> pH-Neutral) sind in der intestinalen Aufnahme wohl auf ca. 200 mg pro Intervall (1-2 h) beschränkt [18]. Auch die Ascorbinsäure, welche deutlich besser aufgenommen wird, bringt das Vitamin C immer noch nicht in die Zelle. Um das zu leisten bedarf es weiterer enzymatischer Transporter und genug NADPH – fehlt irgendwas, bleibt das Vitamin C ‘draussen’. Um das Vitamin C und andere Vitamine und Stoffe nun effizient vom Magen bzw. Darm in das Blut und von da (ohne enzymatischen Transporter) in die Zelle zu bekommen sind liposomale Zubereitungen eine Alternative [2][3][7][11][15].
Liposomen sind dabei im ‘einfachsprech’ Fettkügelchen, die etwas wässriges einschließen – z.B. in Wasser gelöste Ascorbinsäure oder Natrium-Ascorbat. Die mit Vitamin C gefüllten Liposomen können, wenn Sie klein genug sind, der Theorie nach, die Mundschleimhaut und die Darmbarriere (Enterozyten) intakt überwinden und in das lymphatische System passieren. Im Blut können die Liposomen dann leicht an Zellmembranen andocken, da deren äußere Fettschicht der unserer Zellen sehr ähnlich ist (-> Phospholipide). Das Vitamin C (oder anderes) kann so direkt in die Zellen transportiert werden, wobei es dafür keinem sogenannten ‘aktiven Transporter’ mehr bedarf. So könn(t)en auf diesem Wege höhere intrazelluläre Konzentrationen (z.B. von Vitamin C) erreicht werden [3][18] u.a. auch im Vergleich zu Infusionen, da es auch hier immer noch eines (energieaufwändigen) Transports über die Zellmembran bedarf – der wiederum von vielen (vorgenannten) Co-Faktoren abhängt [27].
So, genug der Einführung, worum geht es nun in diesem Artikel?
- Etwas zu den Grundlagen von Liposomen
- Was ist der Kernunterschied der liposomalen Zufuhr, u.a. zur Infusion?
- Die Aufnahme: Mundschleimhaut, Enterozyten, Pfortader und das intestinale Lymphsystem
- Kurz zu Verfahren für die Herstellung von ‘echten’ Nano-Liposomen
- Andere Zutaten wie Cholesterin & Co.
- Taugen alle Produkte am Markt etwas, und was beutet ‘Nano’?
- Haltbarkeit von liposomalen Produkten & Zubereitungen
Am Ende des Artikels folgt dann mein übliches Fazit. Interessierte sein auch noch auf meine dreiteilige “liposomales Vitamin C” Selbstbauserie verwiesen.
Inhaltsverzeichnis für den Schnellzugriff
Etwas zu den Grundlagen von Liposomen
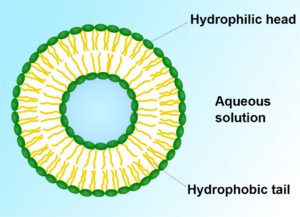
Liposom. Quelle Wikimedia. Lizenz: CC BY-SA 3.0, Autor: SuperManu
Liposomen wurden erstmals 1964 beschrieben und und finden seither in allen möglichen Produkten Verwendung, von Medikamenten bis hin zu teuren Hautcremes. Die Wurzel des Namens Liposom stammt von den altgriechischen Begriffen Lipos (Fett) und Soma (Körper). Kurzgeschrieben sind Liposome Phospholipide, die stabil in Wasser sind und ein wasserlösliches inneres transportieren bzw. beherbergen können (wie z.B. Vitamin C oder B-Vitamine).
Liposomen, die wenige zehn (optimal), mehrere hundert Nano- (nm) aber auch Mikro- (µm) groß sein können, sind Vesikel (Partikel, Bläschen), die aus mindestens einer Fett- bzw Lipid-Doppelschicht (Membranhülle) bestehen, die einen wässrigen Kern (Wässrige Phase) umgibt. Die Fettmoleküle, meist Phospholipide und Fettsäuren, sind so angeordnet, dass sie nach außen und innen hin ein hydrophiles (wasseranziehendes) Milieu schaffen, so das im Inneren der Liposomen wasserlösliche Stoffe verpackt werden können. Dieses ist deswegen so, da Phospholipide ein wasserliebendes Ende (Hydrophil) und ein fettliebendes Ende (Hydrophob) haben: Die fettliebenden Enden streben dann nach innen (siehe Bild) schließen mit ihren hydrophilen Enden die (z.B. mit Ascorbinsäure gesättigte) wässrige Lösung im Kern ein. Die anderen wasserliebenden Ende bilden die Membranhülle – und all das passiert automatisch – also die Formung der liposomen ‘Kügelchen’, wie nebenstehend abgebildet. [27]
Ach ja: Es können auch fettlösliche Stoffe liposomal verpackt werden, wobei diese sich dann nicht im Inneren des Liposoms, sondern in der (mittigen) Fettschicht eingelagert werden – was aber nicht Aspekt dieses Artikels ist. [11]
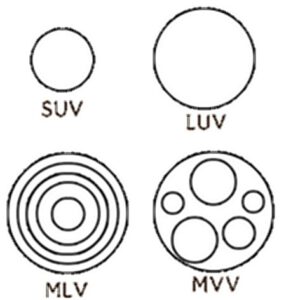
Liposom-Typen und Größen. Quelle Wikimedia. Lizenz: CC BY-SA 3.0, Autor: Nchan
Allerdings ist bei der ‘natürlichen’ Bildung von Lipsomen nicht sichergestellt, welche Form Sie Annehmen und wie groß diese sind. Eine geringe Größe der Liposomen ist jedoch vorteilhaft, weil es dadurch möglich wird, Gewebe im menschlichen Körper zu durchqueren, z.B. aus dem Darm in den Blutkreislauf zu gelangen – und dann subsequent in andere Körperteile. So werden Liposomen auch dazu benutzt um z.B. funktionale Naturstoffe wie Curcumin, was aufgrund seiner Hydrophobizität schlecht bioverfügbar ist, besser verfügbar zu machen [9]. Andere Beispiele wären dann grundsätzlich alle wasserlöslichen Substanzen, wie schon eingangs angeführt, pflanzliche Extrakte wie Kurkuma und z.B. Glutathion (GSH), wobei ich vom letzterem (also dem GSH) bei einer Schwermetall-Belastung mit Quecksilber eher absehen würde – außer man weiß hoffentlich (wirklich) was man macht.
Einfach ausgedrückt, ähneln Liposomen Blasen, die ihren Inhalt schützen und ihn zu einem bestimmten Zielort transportieren. Im Falle des liposomalen Vitamin C sind die Zielorte die Zellen des menschlichen Körpers und der Inhalt der Bläschen das Ascorbat, wobei die höhere Verfügbarkeit auch mit Studien belegt ist [2][7]. Bei letzterem, also dem ‘Beleg’ ist aber Vorsicht bei der Interpretation angebracht, denn hier wird (in der Regel) nur orales Na-Ascorbat mit liposomalem Na-Ascorbat verglichen – ein aus meiner Sicht schlechter Vergleich, weil orale L(+)-Ascorbinsäure deutlichst besser als Na-Ascorbat aufgenommen wird.
Nun gibt es jedoch ein ganz großes ‘aber’: Entscheidend für die biologische Verfügbarkeit ist unter anderem die Größe der liposomen Partikel, wobei es hier wohl dramatische Unterschiede zwischen Mikro (>100 nm) und Nano-Bereich (<100 nm) gibt. Ein ‘ungefähres’ Merkmal um den Unterschied zu erkennen ist ob die Flüssigkeit milchig oder klar ist – denn sind die Partikel im Nano-Bereich, dann wird das Licht nicht gebrochen, die Flüssigkeit erscheint klar. Nach Dr. Shade sind denn auch dramatische Unterschiede bei der Bioverfügbarkeit (u.a. auch Zeit der Anflutung) messbar. So sind denn auch viele ‘liposome’ Produkte nicht optimal bzw. kaum ‘besser’ wirksam, weil diese nicht intakt von Magen bzw. Darm in das Blut gelangen oder dort nicht an die Zellen ‘andocken’ können. So unterscheidet man bei Liposomen dann auch zwischen verschiedene Formen (Strukturen) [26]:
| Liposom-Typen | Größe | Anzahl Lamellen |
|---|---|---|
| Small Unilamellar Vesicles (SUV) | 20 nm – 100 nm | Eine |
| Large Unilamellar Vesicles (LUV) | 100 nm – 400 nm | Eine |
| Giant Unilamellar Vesicles (GUV) | 1 µm und größer | Eine |
| Large Multilamellar Vesicles (MLV) | 200 nm – ~3 µm | Multiple |
| Multivesicular Vesicles (MVV) | 200 nm – ~3 µm | Multiple |
Ziel einer effektiven Herstellung wären dann SUV und maximal LUV. Zum Vergleich: Eine Nukleare Pore, welche den Transport von Molekülen durch die Kernhülle ermöglichen, hat nur ca. 120 nm Durchmesser. Insofern ist dieses eine interessante Größe, die es optimaler Weise zu unterschreiten gäbe…
Was ist der Kernunterschied der liposomalen Zufuhr, u.a. zur Infusion?
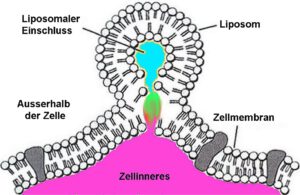
Beispiel für die Abgabe der liposomen Nutzlast in die Zelle.
Levy [27] beschreibt den großen Vorteil von Liposomen folgend:
- Exzellente Absorption: Speziell nach der oralen Gabe, da hier keine Metabolisierungsprozesse in der Leber geschehen, welche die Hauptsubstanz ggf. abbauen oder Limitationen bei Transportern, etc. die Aufnahme beschränken.
- Schutzwirkung: Die Substanzen in den Liposomen werden vor Metabolisierung und Abbau, u.a. durch Enzyme oder im Magen- und Darmtrakt) geschützt – bis die liposome den Wirkstoff an die Zielzelle abgeben.
- Ernährungsphysiologischer Effekt: Phosphatidylcholin ist ein wichtiger Baustoff für Zellmembranen. Es wirkt zudem: Antioxidativ, Cholesterin-Senkend, Gewebe-Protektiv, Leber-Protektiv, Zellmembran-Protektiv, protektiv für die Bauchspeicheldrüse, hemmt die Bildung von Gallensteinen und hat wichtige Funktionen im Metabolismus des Zell-Nukleus und seiner Membran.
- Tiefer intrazellulärer Zugang: Liposome, die mit Ihrem Phospholipid-Hülle Zellmembranen sehr ähnlich sind können den Hauptwirkstoff intrazellulär abgeben (Cytoplasma), aber auch in Strukturen des Zellinneren wie Mitochondrien oder dem endoplasmatischem Retikulum.
- Bessere Versorgung von Makrophagen (Immunzellen) mit Vitamin C bzw. Antioxidanzien, was die Immunantwort verbessern kann.
- Versorgung des gesamten Körpers: U.a. können durch Modifikation der Liposome bestimmte Zelltypen besondern als Ziel für die ‘Payload’ avisiert werden. Aspekte sind dann: Partikel-Größe, Membranstärke (-> Multilamelar, MLV), spzifischer Phospholipid-Typ, etc.
- Weiterhin kann der Vitamin-C-Abbau durch seine Assoziation mit Lipidgrenzflächen, die in liposomalen Formulierungen reichlich vorhanden sind, wohl signifikant reduziert werden [1].
Der aller wichtigste Punkt ist für mich jedoch: Absorption ohne Energieaufwand: Richtige Nano-Liposome (z.B. mit L-Ascorbinsäure) können ihren Inhalt ohne Energieaufwand in das Zellinnere transportieren. Viele große Moleküle müssen ansonsten über spezielle aktive Transporter über die Membran geschleust bzw. transportiert werden, was Energieaufwand bedeutet und andere Co-Faktoren benötigt, die ggf. limitiert sind. Gleiches ist aber auch bei der Infusion der Fall – die ja nur die Grenze der SVT-Transporter im Darm umgeht – aber nicht dafür sorgt, dass das Vitamin C auch in die Zelle kommt (wozu des dann Energie & Co. bedarf!). [27]
Die Aufnahme: Mundschleimhaut, Enterozyten, Pfortader und das intestinale Lymphsystem
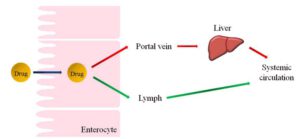
Zwei Wege (Pfortader versus Lymphe) des oralen Medikamententransports in den systemischen Kreislauf. Quelle: [4]. Lizenz CC 4.0
Im Detail geschieht folgendes: Nach oraler Verabreichung passieren die Wirkstoffe den Dünndarm und gelangen dort über die Enterozyten zur Pfortader (-> Leberweg) oder in das intestinale Lymphsystem und schlussendlich in die systemische (Blut-) Zirkulation (siehe nebenstehendes Bild). Der Enterozyt ist dabei die weitaus häufigste Zelle des Dünndarmepithels (-> Darmschleimhaut) und als solche für die Resorption unterschiedlicher Stoffe aus der Nahrung zuständig.
Zwei Hauptfaktoren steuern nun den Weg, den die Wirkstoffe nehmen: Molekularmasse und Löslichkeit. (Wasser-) Lösliche, kleine Wirkstoffe werden bevorzugt über die Pfortader transportiert. Diese Wirkstoffe reichern sich sofort in der Leber an und werden dann durch Enzyme metabolisiert, wodurch die Wirkstoffkonzentration im Blutkreislauf sinkt. Ein alternativer Weg für die Abgabe von Wirkstoffe an den systemischen Kreislauf ist der intestinale Lymphweg. So ist bekannt, dass lipophile Wirkstoffe (-> Liposome) über das lymphatische System transportiert werden. [4]
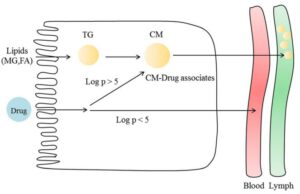
Transportmechanismen von lipophilen Arzneimitteln durch Assoziation mit Lipoproteinen. Quelle: []. Lizenz CC 4.0
Soweit ich es verstanden habe ist das die Basis für die liposome Zufuhr von wasserlöslichen Wirkstoffen unter Umgehung der Metabolisierung in der Leber. Deswegen ist es auch wichtig die liposome Mischung 30-60 Sekunden im Mund zu halten und noch ca. 20 Minuten zu warten bis etwas gegessen wird, denn a) beginnt die Aufnahme im Mund und b) der Rest erst im Dünndarm.
Kurz zu Verfahren für die Herstellung von ‘echten’ Nano-Liposomen
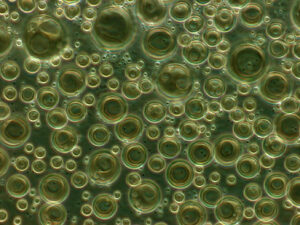
Verschiedene Arten von Phosphatidylcholin-Liposomen in Suspension (SUV, LUV, MLV, MVV). Methode: Phasenkontrastmikroskopie (1000 fache Vergrößerung).
Quelle: Wikipedia, Lizenz: CC BY AS 4.09, Autor: ArkhipovSergey
Nano-Partikel bezeichnet man alles unter 100 Nanometer (nm) Durchmesser – also der Bereich der SUV. Unter dieser Schwelle ändert sich wohl die Kinetik bzw. Pharmakologie der der Liposome in Bezug auf den Transport der eingekapselten Stoffe nochmals deutlich.
Wer sich mit der Herstellung von Nano-Liposomen versuchen mag, der sei auf M.R. Mozafari und seine Mozafari-Methode verwiesen [28]. So stellt M.R. Mozafari in seinem Fachbuchartikel noch andere Verfahren zur Herstellung von Nano-Liposomen her, die allerdings oft technisch sehr aufwändig sind und den Einsatz von speziellen Lösemitteln & Chemikalien bedingen – die dann wieder teils aufwändig entfernt werden müssen. Dabei beschränkt Mozafari sich jedoch auf die mechanischen Verfahren:
- Ultraschall-Methode (mit einer ‘Titanium-Tipped Probe’ -> Ultraschall-Homogenisator z.B. von Bandelin (Sonopuls 4400) oder Hielscher UP 400St),
- wobei hier ggf. Titan aus der Ultraschall-Sonotrode in das Liposom gerät, die Energieverteilung im Medium sehr variabel ist und das Medium erwärmt.
- Extrusions-Methode: Die Rohdispersion wird mittels Stickstoff durch eine Polycarbonatmembran mit definierter Porengröße gepresst.
- Nach etwa 5-10 Extrusionen sind die Zubereitungen hinreichend homogenisiert, wobei die Methode ist für die Liposomen relativ schonend sein soll.
- Wärme– (Heating-) Methode (mit ‘Hot-Plate Stirrer’) – Lösemittelfrei.
- Welche bei den hohen Temperaturen sicher viele Wirksubstanzen in arge Mitleidenschaft zieht….
- Mikrofluidisierung welche mit Drücken über 2000 Bar arbeitet (auch komplexe Gerätschaften nötig… z.B. Microfluidics M-110P)
- Eine Technik die extrem teuer ist und das Medium ggf. stark erwärmt.
Ergänzt wird diese Einführung ggf. noch durch den sehr gut lesbaren Fachtext von Akbarzadeh et al. [23], der noch differenzierter auf die einzelnen Herstellungsverfahren eingeht. Zudem gibt es noch so-genannte Pro- und Trocken-Liposome auf die ich hier nicht weiter eingehe. Allerdings gibt es neben den mechanischen Methoden noch andere Verfahren zur Herstellung von Liposomen, welche ich hier in Verweis auf eine recht interessante Doktorarbeit mit guter Einführung in die Thematik erwähnen mag [7]:
Hinweis: Der nachfolgende Abschnitt ist nur für eingeloggte sichtbar.
Für die Mozafari-Methode [28] bedarf es dann Cholesterin, Nisin, einem ‘Hot-Plate Stirrer’ bis 120 Grad C, einer Argon/Stickstoff-Schutzgasumgebung, wobei das ganze dann dem was mit der Kaltmethode die ich noch vorstellen mag, bzw. der Wärme-Methode am nächsten kommt. Mozafari geht in seinem Übersichts-Paper auch auf die Grundlagen und viele der vorgenannten Verfahren, auf die Messtechnik und die wichtigsten Eigenschaften der zu produzierenden Liposomen ein, wie u.a.:
- (Partikel-) Größe: Bestimmt die Pharmakokinetik, bestimmbar mit Größenausschluss-Chromatographie oder DLS.
- Zeta-Potential: Die Ladung (potential in milli-Volt, mV) des Vesikels in einem Medium,
- was Anziehung und Abstoßung der Vesikel festlegt und damit Verhalten, Stabilität, Pharmakokinetik & Co.
- Wichtig: Je positiver das Zeta-Potential ist (-> kathionisches Lipid), desto zytotoxischer ist es [5], da es durch das hohe Potential andere Zellbestandteile oxidieren bzw. zerstören kann.
- Entwarnung: Liposome aus Phospatidylcholine haben allesamt ein negatives Zeta-Potential, in der Regle wohl um minus 20-25mV [6].
- Gestalt (Shape) / Lamellarität: Also z.B. ob LUV, MLV, MVV, etc., was jedoch ein Elektronenmikroskop braucht (so wie ich es verstehe).
- Verkapselungseffizienz: Messung was überhaupt wie effizient eingekapselt wurde, u.a. mit radioaktivem Zucker oder fluoreszierender Farbe.
Ich warne jedoch schon mal ‘anderweitig’ vor: Wer jetzt einfach mal ‘Shoppen’ gehen möchte: Die Profi-Labor-Geräte starten ab 5000€ für einen einfachen High-Shear Mixer – Zubehör kostet extra. Für ein vernünftiges 400W Ultraschall-Gerät, Ständer & Schallschutz sind schnell 6.000-9.000€ fällig und das beinhaltet noch nicht die anderen Laborutensilien. Glycerin & Ethanol sind noch schnapper – 1 Kg 90% PC kostet dann aber auch schon um die 150€. Insofern wird es in der Regel günstiger sein, seine liposomalen Produktes des täglichen Bedarfs zu erwerben – anstatt zu versuchen diese selber herzustellen. Im Bereich Mikrofluidisierung sprechen wir dann in der Dimension 30.000€ mehr € + Starkstromanschluss und ein bisschen Zubehör.
So denke ich, das richtige Nano-Liposome Produkte nicht umsonst eine ziemliche Stange Geld kosten. Entwicklung, Produktion und Qualitätskontrolle sind hier doch deutlich aufwändiger als ein paar Pülverchen in der richtigen Menge zu vermischen und in Kapseln abzufüllen.
Andere Zutaten wie Cholesterin, PEG & Co.
Cholesterin wird auch oft bei der Herstellung von Liposomen verwendet, da der Einbau von Cholesterin in Liposomen dazu beiträgt, die Fluidität der liposomalen Membrandoppelschicht zu verringern, die wasserlösliche Nutzlast besser zu bewahren und die Stabilität der liposomalen Membran in biologischen Flüssigkeiten wie Blut und Plasma zu verbessern. Ohne Cholesterin interagieren Liposomen häufig mit Blutproteinen und Lipoprotein hoher Dichte und werden so destabilisiert. Teils werden auch (eher ungesunde) Polymere mit hydrophilen Gruppen, u.a. Polyethylenglykol (PEG) verwendet um die Liposome zu schützen (-> ‘Stealth functions’) und bestimmte Zielzellen zu adressieren. Alternativ können auch natürlich gewonnene Polymere, wie Chitosan, zur Stabilisierung von Liposomen verwendet werden. [19]
Darüber hinaus existieren noch viele andere Verfahren um Liposomen so zu bauen, dass damit vorwiegend nur bestimmte Zelltypen adressiert werden, mit Anwendung u.a. im Bereich der Tumor-‘Therapie’ (hüstel). All dies liegt jedoch außerhalb des Fokus dieses Artikels und auch weit außerhalb der Möglichkeiten die zu Hause oder mit noch bezahlbarem Aufwand realisiert und vor allem auch überprüft werden können.
Eine interessante und lange Abhandlung dazu legen Yingchoncharoen et al. (2016) [19] und auch Bozzuto [20] vor. Dort geht es u.a um ein erweitertes Spektrum an Eigenschaften welche in der Anwendung für die Tumor-Therapie bzw. das Zytostatika–Targeting verwendet werden [10]:
- Temperatursensibilität: Liposome, welche durch Anwendung lokaler Hyperthermie ihren Arzneistoff selektiv am Wirkort freigesetzt werden.
- Verweildauer in der Zirkulation: Durch Einbau von Polyethylenglykol (PEG) oder Monosialylgangliosid (GM1) in das Liposom.
- Stichworte: Long-circulating’ bzw. ‘Sterically stabilized’ Liposome
- Aber auch Cholesterol oder Di-Stearoyl-Phosphatidylcholin können die Verweildauer der Liposome verlängern.
- Kathionische Liposomen: Sind Liposomen, die in physiologischem Milieu ein positives Zeta-Potential besitzen und so wohl
- eine bevorzugte Affinität für Endothelzellen in neu gebildeter Tumorvaskulatur zu besitzen und zytotoxisch sind!
- Anm.: Die experimentellen Biontech/Pfitzer Gen-Therapien nutzen kathionische, PEG-basierende, Liposomen.
Taugen alle Produkte am Markt etwas, und was beutet ‘Nano’?
Das die Herstellung von Nano-Liposomen nicht trivial ist, sollte klar geworden sein. Nach (dem vorgenannten) Dr. Chris Shade ist das alles gar nicht so einfach, denn einige (oder die meisten?) Substanzen brauchen wohl Partikelgrößen der Liposomen von optimaler Weise um (oder unter) 100 nm – u.a. für Glutathion, das auch bis zur Fusion mit der Zelle eingekapselt bleibt. Die Partikel-Größe, Stabilität, Effizienz, Haltbarkeit & Co. zu messen & bewerten, sowie den Herstellungsprozess reproduzierbar zu gestalten dürfte jedoch die Hobby-Mittel der meisten deutlich übersteigen. So kostet alleine schon eine Untersuchung der Partikel-Größenverteilung um die 400€ – also eine einzelne Bestimmung.
Wie groß die liposomen Partikel (bzw. Vesikel) oder deren Verteilung in den verschiedenen Zubereitungen am Markt sind, das schreiben die Hersteller dann auch nicht auf die Packung. Wie effektiv das Produkt auf Serum-Spiegel wirkt, was in den Zellen ankommt – auch das ist, wenn überhaupt irgendwann mal gemessen, eher ein Geheimnis der Hersteller. So führen dann auch Messungen des Vitamin C im Serum in die Irre und bedeuten gar nichts – wenn das liposomale Vitamin C nicht in den Zellen erhöht wird. Wer misst das alles? Ich weiß es auch nicht.
Shade geht denn auch davon aus, das die meisten Produkte auf dem Markt insofern eher suboptimal oder kaum substantiell besser wirkten als normale orale Zubereitungen. Zum Vergleich: Eine Patentschrift [15] gibt an, das die Vitamin-C Liposome von LivOn Labs (einem Markführer) vor ein paar Jahren recht groß waren – im Bereich von 1000 nm (übersetzt mit deepl.com):
“Der mittlere Partikeldurchmesser reichte von weniger als 850 nm bis über 1200 nm mit einer mittleren mittleren Partikelgröße von 1030±100 nm”
Das wäre von meinem Verständnis her ziemlich schlecht. Ob dies auch auf das aktuelle Produkt zutrifft ist mir nicht bekannt – es traf aber wohl mal zu, bevor LivOn Labs vorgenannten Patent [15] kaufte.
Haltbarkeit von liposomalen Produkten & Zubereitungen
Leider halten die liposomalen Zubereitungen (bis auf ein paar löbliche Ausnahmen) wohl nicht so lange wie die Pulver in den Kapseln, da die Liposomen mit der Zeit verklumpen und so zu groß werden um von der der Zelle aufgenommen zu werden. Das Gute: Das ist nicht schädlich – und das Vitamin C kann immer noch normal aufgenommen werden. Der Nachteil: Die viele Arbeit und der Aufwand waren größtenteils umsonst.
Insofern nutze ich auch Ethanol & Glycerin als konservierenden Stabilisator – was auch gleichzeitig noch Lösungsmittel ist. Teils werden auch Kaliumsorbat und andere verwendet – aber auf so etwas verzichte ich lieber. Grundsätzlich sollen mit Ethanol stabilisierte liposomale Produkte ca. 6-12 Monate halten und müssen vor dem Öffnen nicht kühl gelagert werden. Das geht auch grob überein mit den Angaben aus der verwendeten Patentschrift [15] (übersetzt mit deepl.com):
“‘Stabilität’, wie sie hier verwendet wird, bezieht sich auf eine Formulierung, die einen Großteil des eingeschlossenen Agens während und nach der Lagerung zurückhält. In nicht-limitierenden Ausführungsformen behalten die Liposomen nach einer Lagerung von mindestens etwa sechs Monaten oder einem Jahr ihre Stabilität“.
Der Alkoholgehalt ist dann z.B. vergleichbar mit Schweden-Bitter (-> Kräutermischung für die Leber) oder einem gutem Wein. Wer damit Probleme hat, der sollte ggf. auf die weiter oben besprochene orale L-Ascorbinsäure ausweichen bzw. mehr Glycerin verwenden.
Sind liposomale Zubereitungen den Aufpreis wert?
Das Problem bei allen liposomalen Produkten ist, ob speziell die Partikelgröße in Bezug auf den zu transportierenden Wirkstoff so bemessen ist, das dieser effektiv in das Lymphsystem und in die Zelle transportiert werden kann. Zudem muss die ganze Mischung auch stabil sein und während der Lagerung nicht in die einzelnen Bestandteile zerfallen oder ‘verklumpen’, meint, das SUV-Partikel sich zu LUV oder anderem vereinen.
Hinweis: Der nachfolgende Abschnitt ist nur für eingeloggte sichtbar.
Mein letztendliches (aktuelles) Fazit zum liposomalem Vitamin C ist nun: Die Qualität entscheidet wohl letztendlich und beide von mir hier angeführte Studien [1][2] taugen in diesem Aspekt nichts, da sie nur die Serumsspiegel messen – also das, was vom Darm in das Blut gelangt, aber nicht auf die Situation in den Zellen. Ggf. entlädt ja das liposome Na-Ascorbat seine Nutzlast sogar sehr effektiv dorthin – weswegen es im Blut eher ‘niedrig’ bleibt. Aber genau das weiss keiner, weil es keiner misst. So gehen aus meiner Sicht die Aussagen der beiden Studien gegen “null”. Ein altes Sprichwort ist denn auch: ‘Wer misst misst mist’.
Mein Fazit
Dieser Artikel kann nur ein Einstieg in die Welt der Liposome sein – eine Welt die nicht ganz so einfach ist, wie einen manche Hersteller glauben machen wollen [24][25][28][29]. Im Falle wirklich guter Liposome sind Stabilität der liposomen Formulierung, Partikel-Größe und Struktur der Liposomen sowie das Zeta-Potential (-> ‘Ladung’ der Liposome) wichtige Kenngrößen, deren Nachweise & Qualitätskontrolle dann auch nicht mehr trivial (oder günstig) ist [28].
So besteht für mich dann auch die grundsätzliche Frage, ob mit ‘Hausmitteln’ oder bei Feld-Wald-Wiesenherstellern überhaupt effektive und zellgängige liposomale Zubereitungen hergestellt werden können [31] – oder ob es nur ein emulgierter Brei ist. So nutzen z.B. alle mir bekannten (professionellen) Herstellungsprozesse z.B. eine Schutzatmosphäre (u.a. Stickstoff) um die Oxidation durch Sauerstoff-Eintrag zu reduzieren [28] – was auch schon bestimmte Anforderungen an die Herstellung stellt.
Eine offene andere Frage die ich habe, aber nicht konkret beantworten konnte, ist ob liposomale NEM auch ‘schlechte’ Dinge in die Zellen transportieren können – z.B. Kunststoff- oder Metallpartikel, Bisphenole, Weichmacher & Co. aus den Herstellungsanlagen – oder ggf. Verunreinigungen in Form von Pflanzenschutzmitteln. Normal wird ja hier einiges rausgefiltert bzw. kann gar nicht erst vom Darm in das Blut bzw. die Zellen gelangen. Auch mag nicht jede Substanz die oral sinnvoll ist – auch liposomal sinnvoll sein.
Was mich zumindest etwas beruhigt: Etwaige ‘böse’ Bestandteile müssen wasserlöslich, stabil und auch recht klein (< 100 nm) sein um effektiv in Liposomen verkapselt zu werden. Zudem führ Shade aus, das es auch zur ‘natürlichen’ Liposomenbildung im Körper kommt, so dass das Grundkonzept der Phospatidylcholin basierenden Liposome aus meiner (aktuellen Sicht) tragfähig sein sollte. Ob das ganze ‘liposomale Zeugs’ sich am Ende auch lohnt hängt sicher auch vom jeweiligen Wirkstoff ab, der transportiert werden soll.
Links / Quellen
- [1] New oral liposomal vitamin C formulation: properties and bioavailability, Maciej Łukawski et al., Journal of Liposome Research, Published online: 02 Jul 2019, doi: 10.1080/08982104.2019.1630642
- [2] Liposomal-encapsulated Ascorbic Acid: Influence on Vitamin C Bioavailability and Capacity to Protect Against Ischemia-Reperfusion Injury, Janelle L Davis et. al. Nutr Metab Insights, 2016 Jun 20;9:25-30. doi: 10.4137/NMI.S39764. eCollection 2016.
- [3] Primal Panacea, Levy TE, Medfox Pub., 2011, ISBN-13: 978-0983772804.
- [4] Liposomal delivery systems for intestinal lymphatic drug transport, Hyeji Ahn 1, Ji-Ho Park, Review Biomater Res, 2016 Nov 23;20:36. doi: 10.1186/s40824-016-0083-1. eCollection 2016. (Volltext)
- [5] Correlation between Ionic Liquid Cytotoxicity and Liposome-Ionic Liquid Interactions, Suvi-Katriina Ruokonen et al., Chemistry, 2018 Feb 21;24(11):2669-2680. doi: 10.1002/chem.201704924. Epub 2018 Jan 24.
- [6] Variations in the Size and ζ-Potential of Phosphatidylcholine Liposomes with Incorporated Nutriceuticals in the Course of their Initiated Oxidation., Sazhina, N. & Plashchina, I. & Semenova, M. & Pal’mina, Nadezhda., Colloid Journal. 82. 69-75., 2020, DOI: 10.1134/S1061933X20010159.
- [7] Herstellungsoptimierung und in-vitro-Untersuchung von anti-GD2-funktionalisierten Arsen-Liposomen für die gezielte Neuroblastomtherapie, Inauguraldissertation zur Erlangung der Doktorwürde der Fakultät für Chemie und Pharmazie der Albert-Ludwigs-Universität Freiburg im Breisgau, Hannah Sophia Deibel aus Bühl, 2017
- [8] Vitamin C in Health and Disease, Anitra C. Carr and Jens Lykkesfeldt, Printed Edition of the Special Issue Published in Nutrients
- [9] Nanoparticle Encapsulation Improves Oral Bioavailability of Curcumin by at Least 9-fold When Compared to Curcumin Administered With Piperine as Absorption Enhancer, J Shaikh et al., Comparative Study Eur J Pharm Sci, 2009 Jun 28;37(3-4):223-30. doi: 10.1016/j.ejps.2009.02.019. Epub 2009 Mar 10.
- [10] Untersuchungen zur Enkapsulierung von Paclitaxel in kationische Liposomen, Dissertation zur Erlangung des Doktorgrades der Fakultät für Chemie und Pharmazie der Ludwig-Maximilians-Universität München , Friedrich Gruber aus München 2004
- [11] Emerging Research and Clinical Development Trends of Liposome and Lipid Nanoparticle Drug Delivery Systems, John C Kraft et al., Review J Pharm Sci, 2014 Jan;103(1):29-52. doi: 10.1002/jps.23773. Epub 2013 Nov 25.
Hinweis: Der nachfolgende Abschnitt ist nur für eingeloggte sichtbar.
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare