Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Die Zerlegung der wichtigsten Studien: Gregus, Leskova, Grunert, Chekmeneva, Hossain und Bjørklund (Teil 2)

Alpha-Liponsäure – Quecksilber-Chelator oder nicht? Cutler oder Shade? Bildquelle: Pixabay
In diesem zweiten Teil, welcher der Frage nachgeht ob die (RS-) Alpha-Liponsäure ein effektiver Quecksilber-Chelator ist wie A. Hall Cutler es schon vor über 20 Jahren vermutete, möchte ich mich die Studienlage vertiefen und die Leser auf diese Reise mitnehmen.
Warum dies überhaupt „eine Frage ist“ und warum diese Frage relevant erscheint hatte ich bereits im ersten Teil ausgeführt. In diesem zweiten Teil möchte ich nun eine ‚Tiefbohrung‘ in die relevanten Studien durchführen, welche insbesondere Cutler als Basis für sein Protokoll angegeben hat:
- Ein kurzer Blick auf Biewenga, R-ALA und DHLA
- Ein weiterer Blick auf Brown, Chekmeneva, Hossain und Bjørklund und der Chelatorenfähigkeit von DHLA in Bezug Hg2+
- Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Zu den Grundlagen
- Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Cutlers Perspektive
- Ishii et al. (2010) und ALA-Glutathion-Mischdisulfide die Gregus et. al. erwähnen
- Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Zu den Daten
- Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Ein Nachschlag zur Hg-Verschiebung in Gehirn & Co.
- Die Studie von Leskova et al.: „Schützende Wirkung von Liponsäureamid bei experimentellem Merkurialismus“
- Die Studie von Grunert (1960) zu ALA und Hg an Mäusen und Hunden
- Studie von Geir Bjørklunda et al. (2019): ALA als Pro-Oxidant & Nrf2-‚Upregulator‘
- Perspektiven von Greg (Biotoxin Journey) und Patrik Askert (Medical Insider) zu (R-)ALA
Am Ende des Artikels folgt dann meine Zusammenfassung und mein aktueller „Reim“ auf vorgestelltes. Um diesen Artikel zu verstehen, also worum es wirklich geht und warum das wichtig ist, bietet es sich an folgendes vorher zu lesen:
- Meinen Artikel zum Cutler-Protokoll
- Meine Einführung in die Alpha-Liponsäure, Teil 1 und Teil 2
- Meine Einführung zu NRF2, Teil 1.
- Meinen ersten Teil dieser Serie.
- Ggf. auch meinen Artikel zu C. Shade und dem Shade-Protokoll.
Ich mag hier schon einmal anmerken, das dieser Artikel ‚keine leichte Kost‘ ist – ich habe mehrere hundert Stunden in meine Nrf2/ALA-Serie investiert um auch nur halbwegs durchzublicken und musste mich tief in die Studien sowie deren Interpretation einlesen. Nicht alles ist immer so offensichtlich wie es auf den ersten Blick (er)scheint.
Inhaltsverzeichnis für den Schnellzugriff
Ein kurzer Blick auf Biewenga, R-ALA und DHLA
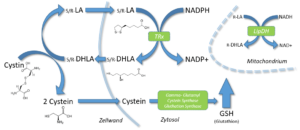
Die Haupttransformationen des LA/DHLA-Redoxpaares. Zelluläre Aufnahme von exogenem LA und seine extrazelluläre Freisetzung; die mitochondriale Reduktion von R-LA zu R-DHLA in Gegenwart von Dihydro-Lipoamid-Dehydrogenase und zytosolische Reduktion von S/R-LA zu S/R-DHLA in Gegenwart von Glutathion-Reduktase oder Thioredoxin-Reduktase.
Da Cutler die RS-ALA und Shade R-ALA verwendet möchte ich hier am Anfang noch einmal kurz auf die potentiellen Unterschiede der beiden Varianten eingehen. In der Veröffentlichung von Biewenga [10] steht einiges zum dem damaligen (1997) Stand von Liponsäure, u.a. auch den verschiedenen Verhalten des R- und S-Enantiomers der Alpha-Liposäure. Die natürlich Form ist die R-Form (R-ALA), wobei bei der synthetischen Herstellung auch zu 50% S-ALA anfällt, was dann den 50/50-Mix aus R- und S-Form, das RS-ALA ergibt.
Wichtig: Auch wenn es nicht die „natürliche Form“ ist, ist RS-ALA die allgemein „übliche“ Form welche in fast allen klinischen Studien verwendet wurde und auch die Form auf der Cutler sein Protokoll basiert.
Heute ist es möglich, die R-ALA Form aus der RS-ALA Mischung zu extrahieren – allerdings treibt dieses den Preis in die höhe und der Nutzen bleibt teils fraglich. Chris Shade (Quicksilver) verwendet jedoch R-ALA, weil er der Ansicht ist, das dieses potenter im Hinblick auf die Induktion von Nrf2 ist. Da ich das meiste zu diesem Thema schon in Teil 1 meiner Serie zu Alpha-Liponsäure geschrieben habe, ergänze ich hier nur noch einige Details auf Basis von Biewenga [10]:
- Die Dihydro-Lipoamid-Dehydrogenase (LipDH) reduziert in den Mitochondrien die R-Liponsäure (unter Verbrauch von NADH), etwa 28-mal so schnell wie das S-Enantiomer,
- S-ALA kann jedoch als LipDH Inhibitor wirken – aber wohl nicht bei hohen NADH-Konzentrationen.
- Die GSH-Reduktase reduziert die S-Liponsäure (unter Verbrauch von NADPH) etwa doppelt so schnell wie die von R-Liponsäure.
- Bei der Reduktion zu S-DHLA (aus S-ALA), durch die GSH-Reduktase, kann S-DHLA die R-Liponsäure nicht enzymatisch reduzieren,
- wobei für mich offen ist, was Netto besser wäre -> nur R-ALA oder RS-ALA.
Insgesamt sind die Interaktionen komplex und es ist liegt außerhalb meiner zeitlichen Möglichkeiten, hier tiefer zu bohren und die systemischen Unterschiede herauszuarbeiten. Neuere Abhandlungen zu R-, S- und RS-ALA [12][23][30][31][32] machen jedoch deutlich, dass das R-Enatiomer klar das bioaktive ist und zu höheren Anstiegen der Liponsäure (und wohl auch DHLA) im Blut bzw. Plasma führt. Auch ist nachgewiesen, das R-ALA in Bezug auf den Anstieg von Glutathion, die Induktion von Nrf2, die ATP-Synthese, die Chelierung von Kupfer, die Bildung von DHLA potenter ist, als die S-Form [30]. Allerdings gibt es wohl Fälle (u.a. die Augenlinsen von Ratten), wo die RS-ALA Variante (wohl über die Zeit) mehr DHLA als die R- oder S-Variante allein gebildet hat, was u.a. darauf zurückgeführt wird, das S-LA langsamer zu DHLA konvertiert wird [10]. Ob hier jedoch zwischen S-DHLA und (R-)DHLA unterschieden wurden habe ich nicht recherchiert. Auch ist mir unklar ob es einen Unterschied zwischen S-DHLA und R-DHLA bei der Bildung von Komplexen mit Hg2+ gibt.
Festzustellen ist für mich jedoch, das ein geringerer ‚Peak‘ von DHLA im Blut und den Zellen (nach Gabe von RS-ALA anstatt R-ALA), der dann jedoch länger anhält, in Bezug auf eine potentielle Chelatorwirkung (und Halbwertzeiten) vorteilhafter scheint. Allerdings werden diese Fragen zu DHLA (bzw. S- und R-DHLA) wohl in absehbarer Zeit nicht beantwortet werden, da DHLA (und seine R- bzw. S-Varianten) im Körper sehr schwer zu messen sind. Biewenga dazu [10]:
„In vivo wird der Nachweis von DHLA durch seine hohe Reaktivität erschwert. In menschlichem Plasma zum Beispiel reagiert DHLA, das dem Plasma zugesetzt wird, sofort mit Plasmakomponenten“
Was für mich hier übrig bleibt ist:
- R-ALA führt anscheinend zu einem schnelleren (und höheren) Anstieg von Glutathion, DHLA und ATP im Vergleich zu RS-ALA (ggf. auch über Induktion von Nrf2),
- jedoch wohl auch zu einen schnelleren Abfall der DHLA-Konzentrationen (im Vergleich zu RS-ALA)
- Letzteres würde im Fall von R-ALA bedeuten, dass diese Form das Risiko steigert schnell viel Hg zu mobilisieren jedoch ebenso schnell wieder ‚fallen‘ zu lassen,
- also für den Fall, das DHLA eine im Menschen relevante Chelatoren-Wirkung entfaltet.
So wird klar, das sich RS-ALA unterschiedlich zu R-ALA (und auch Na-R-ALA) verhält, speziell in Bezug auf erreichte Werte im Plasma und in Bezug auf die Halbwertzeit – etwas was Cutler empirisch festgestellt hatte und der Grund war, warum er von der Verwendung von R-ALA in Zusammenhang mit seinem Protokoll abrät.
Ein weiterer Blick auf Brown, Chekmeneva, Hossain und Bjørklund und der Chelatorenfähigkeit von DHLA in Bezug Hg2+
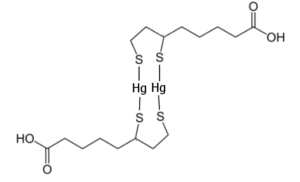
Eine mögliche chemische Struktur des Komplexes zwischen DHLA und Hg 2+, basierend auf den Überlegungen im Internationalen System (Basierend auf G. Bjørklund et al, 2019)
In Teil 1 zur Alpha-Liponsäure ging ich schon auf diese Studien ein (bitte lesen), die nahelegen, dass ALA ein potentieller Hg2+ Chelator ist, wobei bis heute allerdings eine detaillierte Beschreibung der Hg2+-Komplexierung durch DHLA aussteht [6]. Biewenga [10] gibt als Quelle für die Chelatorenfähigkeit von ALA mit Hg2+ Brown et al (1970) [11] an. Brown et al. untersuchten in Ihrer Studie u.a. die Bindungsaffinitäten von ALA and Hg2+ und schrieben (deepl.com):
„Die Hypothese, dass das Coenzym LA (Anm.: ALA) eine Quecksilbervergiftung verhindert [6, 7] und ein wirksames Therapeutikum bei deren Behandlung ist, wird durch die Beobachtung gestützt, dass zwischen LA und dem Quecksilberion ein Komplex gebildet wird. Mit den anderen Metallen bindet die reduzierte Form des Coenzyms, DHL (Anm.: DHLA), und daher könnte DHL bei der Behandlung von Vergiftungen, die durch andere Metallionen als Hg 2+ verursacht werden, nützlicher sein. Weitere detaillierte Studien wären lohnenswert.“
Wer in die Studie von Brown schaut wird dann noch folgendes lesen [11] (Deepl.com):
„Die beiden Mercaptid-Liganden DMP und DHL (Anm. DHLA) reagierten mit allen Metall-Ionen leicht zu unlöslichen Feststoffen. Bei Ni 2+ und Hg 2+ zeigen die analytischen Daten, dass das Bindungsverhältnis nahe bei einem Liganden pro Metallion liegt.„
„Mercaptid-Liganden“ bedeutet in diesem Falle Thiol- (SH-) Gruppen (-> alte Bezeichnung), was bedeutet würde, das ein DHLA Molekül an 2 Hg-Ionen binden würde, was jedoch nur einer schwachen Bindung entsprechen würde. Chekmeneva et al. [4][5] bestätigen dies, wobei Bindungsmuster wohl ph-Wert abhängig sind und die Hauptkomplexe, je nach Messmethode, sowohl (hauptsächlich) 1:1 , aber auch 1:2, 2:2, 2:4 und 4:4 waren , welche u.a. durch ESI-MS-Spektroskopie nachgewiesen wurden [5]. Die pH-Wert Abhängigkeit, je nachdem wie diese konkret ausfällt, macht eine Gesamtbewertung im Kontext des menschlichen Organismus und der Ausscheidungsorgane ggf. Hoch-Komplex.
Wie schon in Teil 1 zu ALA geschrieben, merken Bjorklund et al. [31] an, dass nur durch die Beteiligung mehrerer Ligandenanteile eine stabile lineare Konfiguration mit zwei Thiolgruppen für jedes Hg2+ Metallion entstehen kann. Meint: Es braucht 2 DHLA-Moleküle um ein Quecksilber-Ion zu binden, wie auch im oben- und nebenstehenden stehenden Bild gezeigt. Dies, weil ein Hg-Molekül nicht zwischen die beiden SH-Gruppen von DHLA passt (wie auch bei DMPS und DMSA).
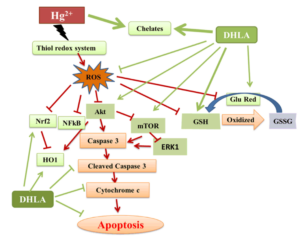
Eine vereinfachte Darstellung der regulatorischen Effekte von DHLA gegen iHg-induzierte Zytotoxizität in PC12-Zellen. Quelle: Hossain et al. (2020) [26]
„Daher legen wir nahe, dass die chelatbildenden Eigenschaften von DHLA mit Hg2+ stark für die Hemmung der Hg-Akkumulation und den daraus resultierenden Schutz von DHLA vor Hg2+-induzierter Toxizität in PC12-Zellen verantwortlich sein könnten“
Allerdings schreiben Hossain et al. auch, dass DHLA die durch Hg2+ ausgelöste intrinsische Apoptose in PC12-Zellen nicht nur über die Hemmung der Hg-Akkumulation, sondern durch
- die Verbesserung des Gehaltes and Glutathion-Reduktase,
- der Hemmung der GSH-Oxidation,
- die Minderung der DNA-Degradation,
- die Hemmung der Laktatdehydrogenase (LDH) Entladung sowie
- die Hemmung Cytochrom-c-Leckage aus den Mitochondrien bewirkt und
- Einfluss auf zahlreiche Proteinexpressionen (akt, p-akt, mTOR, GR, NF-kB, ERK1, Nrf2, HO-1, gespaltener Caspase 3 und Cytochrom c) hatte.
Patrick (2002) [8] fasst in Ihrem hervorragenden Paper dann den damaligen Stand der Dinge zusammen und formulierte Ihr Fazit folgendermaßen vorsichtig:
„Abgesehen von den Spekulationen gibt es eindeutige Hinweise darauf, dass ALA und seine reduzierte Form DHLA die Fähigkeit haben, sowohl als intra- als auch als extrazelluläre Schwermetallkomplexbildner zu wirken, wobei die Toxizität und die Muster der Schwermetallmobilisierung und des Schwermetalltransports beim Menschen noch nicht verstanden sind.“
In Verweis auf Gregus [1] schreibt Patrick auch, das die Fähigkeit von ALA (bzw. DHLA) bei der Bewegung (bzw. Inhibierung) von Schwermetallen aus der Leber elementspezifisch zu sein scheint. Insofern kann man nicht pauschal von einem Element auf das andere schließen, nicht einmal in Bezug auf Hg2+ und MeHg, weil DHLA wohl komplexe mit Hg2+ bildet, aber die Ausscheidung von MeHg in der Leber dosisabhängig reduziert. Wie Cutler [14], weist auch Patrick [8]darauf hin, das ALA Hg im Körper umverteilen kann – auch in das Gehirn, wenn dort die Hg-Konzentration geringer ist, als im restlichen Körper oder Organen. Ob dies eine direkte oder indirekte Folge (-> über Nrf2, Glutathion) der Gabe von ALA ist bleibt leider offen. Cutler beschreibt ähnliches auch für Infusionen von GSH [14].
Was für mich übrig bleibt:
- Ob DHLA nun in vivo (im Menschen) ein effektiver Chelator ist – also unter den jeweiligen pH-Verhältnissen und in der ganzen Kette von der Zelle bzw. dem Mitochondrium, über das Blut, die Leber, den Gallenkanälen und im Stuhl – das ist aus meiner Sicht immer noch ungeklärt. Die Vermutung liegt sehr nahe, der Beweis fehlt.
- Im Falle, das DHLA Hg2+ Ionen direkt und effektiv binden kann, ist immer noch zu klären, welchen Anteil dieser Effekt im Vergleich zu der ALA-vermittelten Hochregulierung der GSH-Systeme über die Induktion von Nrf2, aber auch der verbesserten GSH-Synthese und dem GSH-Recycling, hat.
Letztendlich ist eine quantitative Bewertung der potentiellen In Vivo Chelatorenfähigkeit von ALA (bzw. DHLA) auf Basis der bisher referenzierten Studien für mich nicht möglich. Deswegen werde ich versuchen in den Folgesektionen die Studien von Gregus [1] und Leskova [3], auf die sich Cutler stützte, näher zu betrachten.
Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Zu den Grundlagen
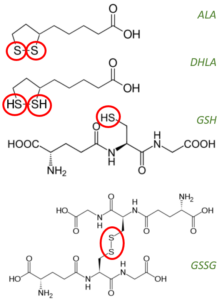
Die Redoxpaare ALA<->DHLA und GSH<->GSSG in der Übersicht.
Die Studie von Gregus et al. [1] ist die primäre Studie auf die sich Cutler, neben Leskova [3], immer wieder bezieht. Die Studie wurde an Ratten durchgeführt, aber die Studie ist weitgehend biochemisch; das heißt, sie hängt von der Chemie der untersuchten Verbindungen ab und nicht von der einzigartigen Biologie oder Physiologie der Ratte. In der Studie geht es um die Wirkung von RS-Alpha-Liponsäure in Bezug auf die Ausscheidung von Schwermetallen und Glutathion. Zu besseren Orientierung möchte ich vorab noch ein paar Begriffe definieren:
- Disulfid: Eine Substanz mit zwei Sulfiden (S-x-S). Ein Sulfid ist eine Verbindung, an die ein einfaches Schwefelatom gebunden ist, wie z.B. HgS (Quecksilbersulfid). ALA & GSSG (oxidiertes GSH) sind Disulfide (-> zwei Schwefelatome). Schwefel steht im Periodensystem direkt unter Sauerstoff und teilt einige seiner reaktiven Eigenschaften; ein Sulfid ist ähnlich wie ein Oxid.
- Dithiol: Eine Verbindung, die zwei SH-Radikale (Schwefel und Wasserstoff) enthält (HS-x-SH) wie z.B. GSH und DHLA.
- DHLA: Dihydroliponsäure (-> reduziertes ALA).
- NPSH: Fassen das biliäre Glutathion (GSH) und seine thiolgruppenhaltigen Hydrolyseprodukten (d. h. Cystein und Cysteinylglycin) zusammen. Diese entstehen aus GSH durch dessen intrabiliäre (-> in der Leber) Hydrolyse, initiiert durch die y-Glutamyltransferase, die sich an der luminalen Oberfläche des Gallengangs befindet, gebildet werden.
Grob gesagt hatte man in dieser Studie an Ratten folgendes in verschiedenen Kombinationen bzw. zeitlichen Abständen gemacht (Dosierungen auf einen 70 Kg-Menschen umgerechnet, wobei die stofflichen Bruttomengen nicht den äquivalenten physiologischen Mengen beim Menschen entsprechen, welche in anderen Verhältnissen umgerechnet werden müssen):
- Ihnen ca. 500, 1000, 2000 und 4000 mg RS-ALA infusiert (-> LA; Thioctsäure; 37,5, 75, 150 und 300 µmol/kg)
- Ihnen ca. 170 mg Methyl- bzw. anorganisches Quecksilber neben anderen Metallen infusiert (Cu, Zn, Cd) (-> 10 µmol/kg)
- Ihnen alternativ Diethylmaleat (DEM), einem Glutathion-Antagonist, intraperitoneal (ip) injeziert.
Dann wurde jeweils folgendes gemessen:
- die Galle (-> biliäre Ausscheidung) auf Hg2+, MeHg (alle 4 ALA-Dosierungen), Zn2+, Cu2+, Cd2+ (nur ALA mit 150 µmol), GSH, GSSG und Cystein (nur 37,5 und 300 µmol),
- das Blut in Bezug auf GSH, Cystein (Cys), Cystin und das gemischte Disulfid von Cys und GSH (CysSG) (nur ALA mit 37,5 und 300 µmol/kg),
- der gesamten Gallenfluss (Menge) und die NPSH (nur ALA mit 75, 150, 300 µmol) sowie
- die Blut- und Organ-Konzentration von Hg2+, MeHg, Zn, Cu, Cd nach Gabe von RS-ALA (nur 150 µmol/Kg)

Die Haupttransformationen des LA/DHLA-Redoxpaares. Zelluläre Aufnahme von exogenem LA und seine extrazelluläre Freisetzung; die mitochondriale Reduktion von R-LA zu R-DHLA in Gegenwart von Dihydro-Lipoamid-Dehydrogenase und zytosolische Reduktion von S/R-LA zu S/R-DHLA in Gegenwart von Glutathion-Reduktase oder Thioredoxin-Reduktase. Die Verbindung zwischen dem LA/DHLA-System und der zellulären Cystein-Aufnahme und GSH-Synthese. Basierend auf [33]
- (3) ALA erhöhte die biliäre Ausscheidung von reduziertem Glutathion (GSH) in einer dosisabhängigen Weise.
- (4) Hohe Dosen von ALA (150 µmol/kg und mehr, iv) reduzieren die biliäre Ausscheidung von MeHg, Cd, Zn, Cu – und bei MeHg in einer Dosisabhängigen weise (bei Cd, Cu, Zn nur mit 150 µmol gemessen).
- Eine Kontrollgabe mit DEM (-> vermindert GSH in der Leber) reduzierte ebenfalls die biliäre Ausscheidung von MeHg, Cd, Cu, Zn, welche mittels GSH-Komplexen aus der Leber in die Gallenkanäle befördert werden.
- Allerdings reduzierte die Gabe von DEM nicht die Ausscheidung von Hg2+
- (5) Hohe Dosen von ALA (150 & 300 µmol) veränderten die Ausscheidung von anorganischem Quecksilber (Hg2+) nur minimal gegenüber den niedrigen (37,5 und 75 µmol), erhöhten aber die Ausscheidung, je nach Zeitpunkt dramatisch (12- bis 37-fach).
- (6) Die Gabe von ALA reduzierte die Konzentrationen endogener Disulfide im arteriellen Blutplasma dosisabhängig (z.B. Cystin, Glutathion-Disulfid (GSSG), Cystein-Glutathion, Protein-Cystein und gemischte Protein-Glutathion-Disulfide), während die Spiegel endogener Thiole (z.B. Glutathion und Cystein) erhöht waren.
- (7) Gregus et al. folgern, das (6) darauf hinweist, dass ALA, wahrscheinlich nach enzymatischer Umwandlung in Dihydroliponsäure, endogene Disulfide zu Thiolen reduzieren kann. Das passt auch zum nebenstehend abgebildeten Zyklus (basierend auf [33])
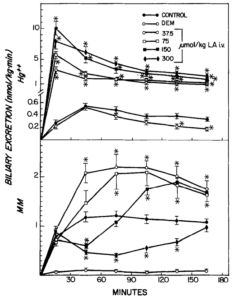
Wirkung von Liposäure (LA) und Diethylmaleat (DEM) auf die biliäre Ausscheidung von anorganischem Quecksilber (Hg) und Methylquecksilber (MM). DEM (0,7 ml/kg, IP) wurde 45 min vor und die LA wurde 1 min nach der Quecksilberinjektion (10 pmol/kg, iv) verabreicht. Die Symbole stellen die Mittelwerte + SE von fünf oder sechs Ratten dar. *Signifikant verschieden (p < 0,05) von der Kontrolle. Quelle: Gregus, 1992
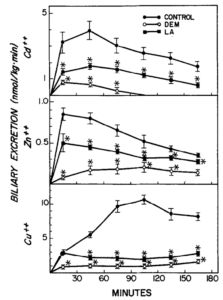
Wirkung von Liponsäure (LA, 150 µmol) und Diethylmaleat (DEM) auf die biliäre Ausscheidung von Cadmium (Cd“), Zink (Zn*+) und Kupfer (Cu“). DEM (0,7 ml/kg, ip) wurde 45 min vor und LA 1 min nach der Injektion von Metallsalzen (10 pmol/kg, iv) verabreicht. Die Symbole stellen Mittelwerte + SE von fünf oder sechs Ratten dar. *Signifikant verschieden (p < 0,05) von der Kontrolle. Quelle: Gregus, 1992
Dann folgen im Abstract verschiedene Hypothesen warum die vorgenannten Messergebnisse eingetroffen sein könnten – speziell der deutliche Unterschied der Ausscheidung von MeHg (sowie Cd, Cu, Zn) im Kontrast zu Hg2+. Eine Hypothese (8) ist die Bildung von ALA-Glutathion-Mischdisulfid-Komplexen [1] (deepl.com):
„wäre es verlockend anzunehmen, dass die biliäre Ausscheidung dieser Metalle durch LA gehemmt wird, weil durch LA ein ALA-Glutathion-Mischdisulfid gebildet wird, das mit den Metall-Glutathion-Komplexen um den hepatobiliären Transport konkurrieren könnte.“
Die Autoren theoretisieren weiter, dass (9) diese ALA-GSH-Komplexe dann erst in der Galle (u.a. Ph-Wert Abhängig) wieder zu ALA und GSH gespalten werden – damit jedoch nicht für die Bindung an MeHg & Co. in der Leber zur Verfügung stehen. Um zu erklären warum die GSH-Verfügbarkeit und die Gabe von DEM keinen Einfluss auf die Hg2+ Ausscheidung hat, merken Gregus et al. an, das (10) die Bindungsaffinität von Hg2+ zu GSH deutlich höher ist als die der anderen Metalle (in Verweis auf Stricks and Kolthoff, 1953; Kapoor et al., 1965), also GSH-Hg2+ Komplexe unberührt bleiben (könnten). Zudem theoretisieren Gregus et al. eine zusätzliche Chelatorenaffinität von DHLA speziell zu Hg2+ während des Transportes durch die Leber, schreiben aber klar, dass dieses durch weitere Versuche bestätigt werden müsse. Cutler sieht diese Wirkung auch – aber Shade bestreitet diese, ohne jedoch (öffentlich dokumentiert) konkret geworden zu sein wie er die Ergebnisse interpretiert.
Jetzt ist natürlich eine offene Frage: Wird Hg2+ ggf. auch durch GSH-Komplexe gebunden und durch DHLA chelatiert oder passiert eher vorwiegend nur ‚eines von beiden‘? Wenn ich auf die nebenstehenden Grafiken schaute und siehe, das die Gabe von DEM (-> macht weniger GSH in der Leber) die Ausscheidung von MgHg & Co. dramatisch reduziert, aber nicht die von Hg2+, dann werde ich nachdenklich. Wenn ich sehe, das die Gabe von ALA zudem die Ausscheidung von Hg2+ Dosisabhängig erhöht, die von MeHg auch, aber nicht bei extremen Dosen von ALA, dann stellen sich zusätzliche Fragen.
Nun gibt es zwei Möglichkeiten: a) Das Hg2+ kommt als DHLA-Hg2+ in die Leber und wird auch so ausgeschieden – der GSH-Spiegel interessiert nicht, oder b) die GSH-Hg2+ Komplexe sind wirklich super-stabil, kommen als solche auch schon in die Leber, so das eine mit DEM an GSH verarmte Leber hier keine Rolle spielt. Denn, dass das DEM die Hg2+-Ausscheidung nicht unter die ‚Baseline‘ verarmen konnte, das muss eine Erklärung haben.
Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Cutlers Perspektive
Cutler schreibt zu der Studie von Gregus et al. [1], das diese ein ausgezeichnete und nützliche Studie ist – wobei er darauf hin weist wirklich den Inhalt zu lesen – und nicht nur die Zusammenfassung. Auf Basis dieser Studie hat Cutler, neben der Ausscheidungskinetik, u.a. folgendes abgeleitet [AC16]:
- ALA erst einige Monate nach Beendigung der organischen Quecksilberbelastung zu starten,
- damit möglichst viel davon in die anorganische Form (Hg2+) umwandelt ist, was ALA besser ausleitet.
- Nur die halbe Zinkdosis während der Chelations-Runde zu verwenden,
- Weil die ALA-Gabe irgendwie die Zink-Ausscheidung senkt.
- Regelmäßige Pausen einzulegen, damit Cu, Cd und Zn ausgeschieden werden können
Cutler weist noch darauf hin, dass die BHS der Ratten nicht so gut wie unsere arbeitet. Dieses ist auch gut an den Daten zu erkennen, denn innerhalb von 3h stieg die MeHg und Hg2+ Konzentration im Gehirn der Ratten um ca. Faktor 3.
Weiterhin schrieb Cutler [AC10], dass aus seiner Sicht die Studie von Gregus ein schlüssiger Beweis für die Chelatbildner-Fähigkeit von ALA ist. Zudem stimmten nach Cutler die Ausscheidungsraten (-> Pharmakokinetik) von Hg mit denen in der Leskova-Studie überein. In Bezug auf die Hg-Konzentration im Gehirn wiederholt Cutler den Hinweis, das anorganisches Quecksilber (Hg2+) zwar nicht die Blut-Hirn-Schranke überwindet, aber ALA sich darauf auswirkt, wie sich das (Körper-) System ein Gleichgewicht zwischen Blut und Gehirn zubewegt. Deswegen gab es bei den mit ALA behandelten Tieren im Gegensatz zu den Kontrollieren eine Nettobewegung von Quecksilber in das Gehirn – wie weiter oben schon angemerkt!
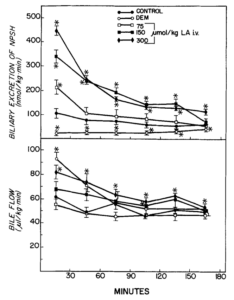
Wirkung von Liponsäure (LA) und Diethylmaleat (DEM) auf die biliäre
Ausscheidung von Nicht-Protein-Thiolen (NFSH) und den Gallenfluss. LA wurde zum Zeitpunkt 0 injiziert. DEM (0,7 ml/kg, ip) wurde 45 min vor der Gallenentnahme verabreicht. Die Symbole stellen Mittelwerte + SE von fünf oder sechs Ratten dar. *Signifikant verschieden (p < 0,05) von der Kontrolle. Quelle: Gregus, 1992
Dann gibt es auch noch aktuelle Kommentare der Co-Autorin von Cutlers 2019er Buch, Frau Rust Lee, welche in verschiedenen Blog-Beiträgen [19][20][21] versucht die Sach- und Fachlage aus Sicht des verstorbenen Cutler aufzuklären – also dass u.a. DHLA ein Hg-Chelator sei. Lee argumentiert so [21], dass wenn Shades Theorie richtig wäre, wir erwarten würden, dass die Diethylmaleat- (DEM-) Behandlung (-> Verarmung an Glutathion) in der Studie von Gregus et al [1] die Leber-Ausscheidung von Hg2+ verringert müsste, was aber nicht der Fall war. Alles läuft nun darauf hinaus zu erklären warum DEM, was GSH aus der Leber entfernt, die Ausscheidung:
- a) von Hg2+ nicht reduziert, aber
- b) die Ausscheidung von MeHg dramatisch reduziert, wobei
- c) die Ausscheidung von Hg2+ mit der Dosis von ALA korreliert (zumindest bis 150 µmol/Kg)
- d) die Ausscheidung von MeHg durch Gabe von ALA zwar steigt, aber von sehr hohen Dosierungen (ab 150 µmol/Kg ~ 2000 mg /70 Kg) kurzzeitig supprimiert wird.
Was zumindest in Bezug auf die Ausscheidung von MeHg verwirrt ist, das Gregus et al. feststellten, dass die biliäre GSH-Ausscheidung direkt nach der Gabe von ALA (dosisabhängig) kurzzeitig stark steigt. Die Autoren schreiben sogar [1] (deepl.om)
„Untersuchungen mit dem Glutathiondepletor DEM, der die NPSH-Ausscheidung in die Galle deutlich verringerte (Abb. l), bestätigten, dass die biliäre Ausscheidung von MM, Cd*+, Zn*+ und Cu*+ glutathionabhängig ist, da DEM die Ausscheidung dieser Metalle in die Galle reduzierte (Abb. 2 und 3).“
Die Frage, warum hohe Dosen von ALA nun (Zeitabhängig) die
- Ausscheidung von NPSH bzw. Glutathion erhöht,
- die von Cd, Cu, Zn auch länger reduziert,
- die von MeHg erhöht, aber bei (sehr) hohen Dosen (150 µmol/Kg) kurzzeitig reduziert
- aber die von Hg2+ in etwa (in der Spitze) mit dem Menge von ALA korreliert (und erst bei 300 µmol in die Sättigung geht)
ist dann eine zusätzliche, welche im vorherigen Abschnitt schon angerissen wurde (-> ALA-Glutathion-Mischdisulfid These). Auffällig ist für mich zudem, dass die Supprimierung der MeHg-Ausscheidung durch ALA nur bei sehr hohen Dosen auftritt. Zudem wird Hg2+ auch ohne GSH ausgeschieden und das Dosisabhängig von ALA. Das ist für mich der Fakt, das ALA auch ohne GSH Hg(2+) aus dem Körper entfernt und GSH selber eben kein Hg(2+)-Chelator ist. Zumindest nicht für Hg2+.
Ishii et al. (2010) und ALA-Glutathion-Mischdisulfide die Gregus et. al. erwähnen
Dass die von Gregus & Co. vermuteten ALA-Glutathion-Mischdisulfide keine reine Theorie sind, bestätigen Ishii et al. [24] in Ihrer Studie zu einer (neuen) Methode zum Nachweis und zur Charakterisierung von α-Liponsäure-Mischdisulfiden. U.a. schreiben Sie:
„These results show the direct evidence that LA forms a mixed disulphide with GSH.„
Weiterhin schreiben die Autoren (deepl.com):
„In dieser Studie zeigen wir den direkten Nachweis, dass ALA ein gemischtes Disulfid nicht nur mit GSH, sondern auch mit dem Sulfhydrylpeptid bildet (Abbildungen 3 und 4). DHLA bildet auch ein gemischtes Disulfid mit oxidierten Thiolverbindungen wie GSSG, kann aber die Reduktion über intramolekularen Thiol-Austausch vervollständigen.“
Die Autoren schließen damit, dass Ihre Ergebnisse und Beobachtungen daraufhin deuten, dass Alpha-Liponsäure ein potentieller Modifikator von redoxabhängigen zellulären Ereignissen sein kann, und zwar sowohl durch Oxidation als auch durch Reduktion von intrazellulären Sulfiden wie Glutathion und Protein-Cystein-Resten. Grundsätzlich kann das, was Gregus & Co. theoretisieren, also geschehen – die Frage ist nur, ob es auch in der Leber passiert.
Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Zu den Daten
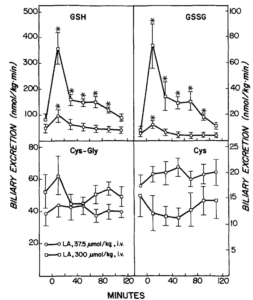
Wirkung von Liponsäure (LA) auf die biliäre Ausscheidung von reduziertem und oxidiertem Glutathion (GSH und GSSG), Cysteinylglycin (Cys-Gly) und Cystein (Cys). LA wurde zum Zeitpunkt 0 injiziert. Symbole stellen Mittelwerte + SE von vier oder fünf Ratten dar. *Signifikant verschieden (p i 0,05) von der vor der LA-Verabreichung beobachteten Ausscheidungsrate. Quelle: Gregus, 1992
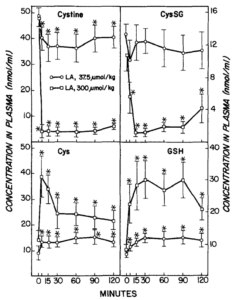
(GSH), Cystein (Cys), Cystin und das gemischte Disulfid von Cys und GSH (CysSG). LA wurde zum Zeitpunkt 0 injiziert. Symbole stellen Mittelwerte +/- SE von vier oder fünf Ratten dar. *Signifikant verschieden (p < 0,05) von der vor der LA-Verabreichung beobachteten Konzentration. Quelle: Gregus, 1992
Hier möchte ich meine Perspektive auf die Studie beschreiben – was mir aufgefallen ist, aber in der Studie und von Cutler nicht hervorgehoben wurde. Vorab gebe ich zu beachten,
- das ALA hier IV und nicht oral gegeben wurde – deswegen sind die zeitlichen Änderungen von GSH, der Hg-Ausscheidung, etc. auch ’so unmittelbar‘.
- Zudem liegen die verwendeten Dosierungen, umgerechnet auf den Menschen, in einem eher hohen Bereich, welche in keiner Weise vom Cutler-Protokoll erreicht werden.
Eine ‚hohe Dosis‘, angenommen nach Cutler-Protokoll, liegt bei IV-vergleichbaren 320 mg / Tag (-> 24h/3h => 8 * 100 mg => 800 mg * 40% Bioverfügbarkeit) und somit unter der geringsten IV-verabreichten Dosis von Gregus. Zudem wird die Dosis von 320 mg auf 8 Gaben über 24 h aufgeteilt und dürfte komplett andere Verläufe zeigen, da es unwahrscheinlich ist, dass hier das negative Feedback in Bezug auf MeHg auftritt.
Was aus meiner Sicht in der Gregus-Studie unter geht, ist auch, dass die Gabe von (sehr hohen Dosen) ALA das GSH und Cystein (-> GSH-Vorläufer) im Blut sehr schnell erhöht, das CysGS (-> bestehend aus der oxidierten Form des freien Glutathiontripeptids ->GSSG, das über eine Disulfidbindung an L-Cystein gebunden ist) und Cystine (-> oxidiertes Cystein) jedoch senkt. Das scheint auch folgerichtig, weil Cystine das Substrat für Cystein ist. Leider ist hier kein Vergleich zu einer Kontrollgruppe angegeben, so das die absoluten Erhöhungen bei der geringsten ALA-Dosierung von 37,5 µmol / Kg im unklaren bleiben.
Dabei ist der hohe Anstieg von Cystein zwar nur kurz, der Anstieg von GSH bleibt (bei 300 µmol/Kg) zumindest 90 Minuten lang sehr hoch. Unabhängig von Kontrollwerten unterscheiden sich die GSH-Werte von 37,5 zu 300 µmol / Kg schon recht stark, was für mich bedeutet, das Biochemisch einiges an (temporären) Steigerungspotential für die GSH-Synthese, induziert durch ALA da ist. Dies ist ein Punkt, der klar für die Interpretation durch Shade spricht.
Wer auf meine Grafik weiter oben schaut, der wird sehen, dass ALA/DHLA ein wichtiges, ggf. begrenzendes?, Redox-Paar ist, um Cystin zu Cystein zu wandeln. Cystein ist dann die Basis (neben Glycin und Glutamin) für die Synthese von GSH. Für all das braucht es natürlich genug NADP(H). Zudem ist ALA ein hoch potenter Nrf2-Inducer, welcher die GSH-Systeme, u.a. auch die Glutathion-Synthase & Co. hoch modulieren. Wie schnell eine Aktivierung von Nrf2 die GSH-System und Phase II & III (Detox-) Enzyme hoch reguliert, das konnte ich bisher nicht ermitteln. Zwar hat Nrf2 nur eine Halbwertzeit von 15-20 Minuten, aber die Phase II & III Enzyme müssen ja erst einmal, basierend auf diesem Signal, gebaut werden. Damit letzteres in ausreichenden Mengen geschieht vergehen sicher einige Stunden.
In vergleichbarer (zeitlicher) Weise wie im Blut, steigen auch die NPSH, GSH, GSSG & Co. in der Galle. Gregus et al. bewegt hier warum (sehr) hohe Dosen an ALA (und GSH im Blut) dann die MeHg-Ausscheidung in die Galle reduziert – anstatt Sie zu erhöhen, jedoch die Hg2+ Ausscheidung quasi linear zur ALA-Dosis steigert. Sie stellen die schon eingangs erwähnte These auf, dass GSH in der Galle komplexiert ist (-> ALA–Glutathion-haltiges gemischtes Disulfid), also nicht als Bildungspartner (für Hg) zur Verfügung steht und erst in der Galle, also nach der Ausscheidung aus der Leber, wieder in GSH und andere Disulfide zerfällt. Nach den Daten von Ishii [24] könnte dies dann grundsätzlich auch so passieren – die Frage ist, ob es (wie weiter oben schon angemerkt) so auch in der Leber geschieht. Gregus et al. schreiben allerdings auch (Deepl.com):
„Die Beobachtung, dass das Glutathion-Konjugat von Sulfobromphthalein die biliäre Ausscheidung von MM nicht hemmt (Ballatori und Clarkson, 1985b), unterstützt diese Annahme jedoch nicht.“
In 1996 hatten Gregus et al. [28] dann noch eine weitere Studie mit ALA durchgeführt, leider mit nochmals 2-5 mal höheren Dosierungen, in der Sie u.a. feststellten (Deepl.com):
„ALA verringerte die hepatische CoA-, Carnitin- und Glutathion-Konzentration, nicht aber ATP, während es die hepatische Glycin-Konzentration erhöhte“
Leider konnte ich die Volltextstudie nicht finden um diese Aussage der Zusammenfassung nachzuprüfen. Das ALA aber in irgend einer Weise, zeit-beschränkt und Dosis-abhängig, das GSH in der Leber reduziert scheint folgerichtig, wenn es in der Galle um Größenordnungen, zusammen mit dem GSSG, ansteigt. Zu guter Letzt schreiben Gregus et al. [1] noch (Deepl.com):
„Die überaus große Thiol-Reaktivität von Hg2+ kann zur Bildung von sehr stabilen Hg2+-Diglutathion-Komplexen mit bis zu drei Quecksilberatomen (Stricks und Kolthoff, 1953; Kapoor et al., 1965) und auch von Glutathion-Hg-Protein-Komplexen (Magos, 1981) führen, die möglicherweise nicht ohne weiteres ausscheidbar sind.“ und „Hg2+ kann aber auch mit Dihydroliponsäure einen äußerst stabilen Komplex bilden, der aufgrund seines Molekulargewichts von über 400 effektiv in die Galle transportiert werden könnte.“
Hier sehen Gregus & Co. also das Problem, das die GSH-Hg2+ Komplexe teils gar nicht über die Membrantransporter (-> BSEP, MRP2 & Co., welche 1992 noch gar nicht bekannt waren) ausscheidbar sein könnten, GSH-DHLA-Komplexe jedoch schon.
Ein Zwischenfazit: Für mich ist es sehr schwer die ALA-IV-Einmalgaben bei den Ratten auf einen Menschen zu interpolieren. Immer wieder sehe ich, das ALA massive Auswirkungen auf GSH hat, was mir Shade seine Sichtweise nahelegt. Die Spiegel von GSH im Blut, sowie die Ausscheidungen von GSH in der Galle korrelieren in der Studie von Gregus & Co. zudem grob mit denen von Hg2+. Die Frage ist aber: Korreliert nun ein hohes GSH einfach mit der Gabe von ALA und der Ausscheidung von ALA-Hg2+ Komplexen, oder ist das Hg2+ mit GSH komplexiert und ALA nur „Stoff“ für mehr GSH?
Eine Tiefenbohrung in die Studie von Gregus et al. (1992) – Ein Nachschlag zur Hg-Verschiebung in Gehirn & Co.
Wer genau in die Studie schaut, oder auf die hier abgebildete (nachfolgende) Grafik, der wird sehen, dass sich das Hg2+ und das MeHg nach der Gabe von ALA im Gehirn anreichern. Nach Cutler ist dies auch zu erwarten, da [AC10] (Deepl.com)
„Anorganisches Quecksilber überwindet die Blut-Hirn-Schranke nicht, so dass eine Ratte, der es gerade injiziert wurde, viel im Körper und nichts im Gehirn hat. Wenn man ihnen ALA gibt, kann sich das System auf ein Gleichgewicht zwischen Blut und Gehirn zubewegen, was in diesem Fall bedeutet, dass bei den behandelten Tieren im Gegensatz zu den Kontrolltieren netto mehr Quecksilber ins Gehirn gelangt. Das ist der Grund, warum ich empfehle, ALA nicht zu verwenden, wenn Sie kürzlich eine Exposition hatten, z. B. in den ersten 3 Monaten nach der Amalgamentfernung.„
Klar zu sehen ist für mich, das MeHg jedoch eine durchaus hohe Affinität für das Gehirn zu scheinen hat..
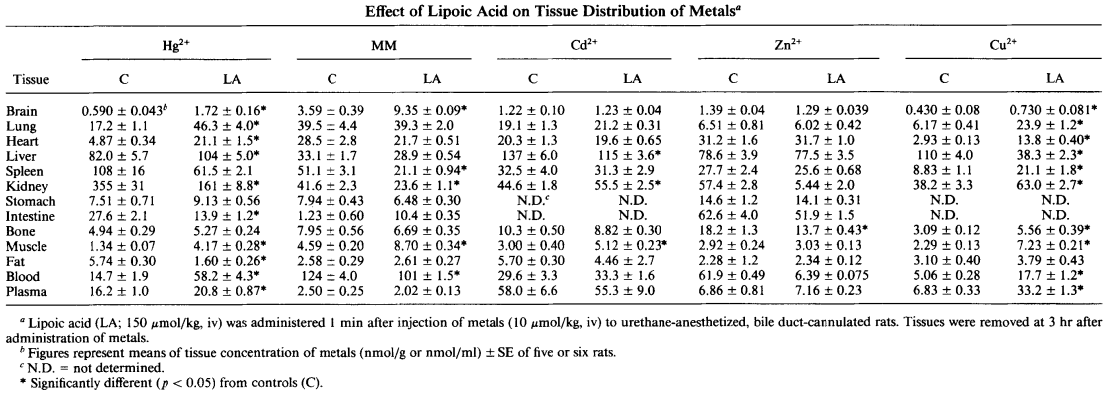
Effekt von ALA auf die Gewebe- und Organkonzentration von verschiedenen Metallen. Quelle: Gregus, 1992
Also: Erst einmal das Hg im Körper senken, bevor mit ALA nachgeholfen & mobilisiert wird.
Die Studie von Leskova et al.: „Schützende Wirkung von Liponsäureamid bei experimentellem Merkurialismus“
Das Ziel dieser Arbeit aus 1979 [3], welche nur auf Russisch und Laienübersetzungen [AC21] verfügbar ist, war die experimentelle Untersuchung der Möglichkeit der Anwendung von ALA zur individuellen Prophylaxe bei Quecksilbervergiftungen. Die Studie wurden an 4 Gruppen von weißen Ratten über 5 Monate durchgeführt (16 Tiere in jeder Gruppe). Die 1. und 2. Gruppe waren die unvergiftete Vergleichsgruppe, die 3. und 4. Gruppe wurde dem täglich Einfluss von Quecksilberdämpfen in einer Konzentration von 0. 8 mg/m³ unterzogen. ALA, mit ca. 10 mg/kg, wurde der Gruppe 2. & 4. (nach der Vergiftungsphase) mittels einem Fütterungsrohr zugeführt. Die primären Schlussfolgerungen waren u.a.:
- ALA in der Dosis von 10 mg/kg hatte keinen schädlichen Effekt auf den allgemeinen Zustand der Tiere.
- ALA vermindert die toxische Wirkung des Quecksilberdampfes auf den Organismus der Tiere (Gruppe 4.)
- Die (Anm.: angenommene) Schutzwirkung von ALA beruht einerseits auf der Bindung an Quecksilber und dessen Ausscheidung aus dem Organismus und andererseits auf dem Schutz der carbothiolischen Gruppen einiger biologisch aktiver Verbindungen.
Unter anderem wurde die Ausscheidung von Quecksilber über die Niere und den Stuhl deutlich verbessert, u.a.:
- Tiere der 4. Gruppe hatten im ersten Monat des Experiments 1,5 mal, im 2. Monat des Experiments 2,3 mal mehr Hg im Urin ausgeschieden aus die 3te Gruppe.
- Tiere der 4. Gruppe hatten im ersten Monat 1,8 und im zweiten 3,3 mal mehr Hg (Gesamt) ausgeschieden als die der 3ten Gruppe.
- Tiere der 4. Gruppe schieden im 1. Monat 2,7-fache mehr Hg im Kot aus, als die 3te Gruppe.
- Tiere der 3ten Gruppe hatten 1,5-fach mehr Hg in der Niere als die der Gruppe 4.
Mein Takeaway?: So spanned diese Daten auch sind, so übereinstimmend Sie mit den Ausscheidungsraten von Gregus et al. [1] sind – nirgends wird der Beweis geführt das die Ausscheidung mittels ALA-Hg2+ Komplexen geschieht. Auch werden die Hg-Spezies, zumindest Hg2+ und MeHg, nicht unterschieden. Shade hat in einem (nicht öffentlichen) Video gleiches gesagt: Der Chef von Geronova hatte einen Doktoranden bezahlt um die Studie von Leskova zu übersetzten – es lies sich jedoch kein Hinweis auf den Nachweis einer direkten Chelatorenfähgkeit von ALA finden. Insofern bleibt auch hier offen, ob ALA über die hochregulierung der GSH-Systeme die indirekte Chelierung mittels Hg2+-GSH Komplexe fördert – oder als direkter Chelator von (zumindest) Hg2+ fungiert. Was jedoch relevant für mich war: ALA zeigt die positiven Effekte von Gregus et al.
- auch bei oraler Gabe,
- bei physiologischen Dosen um 10 mg / Kg (-> 700 mg bei einem 70 Kg Menschen),
- bei Dauergabe über mehrere Monate,
- bei chronifizierten Hg-Belastungen, welche auch Monate zurückliegen und
- weist eine erhöhte Ausscheidung von Hg im Stuhl, aber auch im Urin (über die Niere) nach.
Denn wie Cutler [AC8] oft anmerkte, sind viele Hg-Studien nur mit Akutvergiftungen und teils unphysiologischen Dosierungen durchgeführt worden, welche sich oft schwerlich auf die chronischen Belastungen durch Amalgam-Vergiftungen übertragen lassen. Ansonsten merkt Cutler noch folgendes zur Leskova-Studie an [AC20], das diese zwar keine Messungen des Hg-Gehalts im (püriertem) Gehirn vornahm, jedoch dass die typischen pathologischen Veränderungen, die unter einem Mikroskop beobachtet wurden, bei den behandelten Ratten überhaupt nicht auftraten, und bei der unbehandelten (aber vergifteten) Kontrollgruppe schon. Da es sich bei der Exposition um Quecksilberdampf handelte, von dem bekannt ist, dass er das Gehirn innerhalb von Sekunden nach dem Einatmen erreicht, bedeutet dies, dass die ALA das Quecksilber entweder entfernt oder es völlig ungiftig gemacht hat. Da das Zweite schwer zu glauben ist, folgert Cutler, dass ALA das Quecksilber aus dem Gehirn entfernt hat. Meine Frage ist jedoch: Ist das ALA „direkt“ verantwortlich, oder indirekt über die Erhöhung von GSH?
Die Studie von Grunert (1960) zu ALA und Hg an Mäusen und Hunden
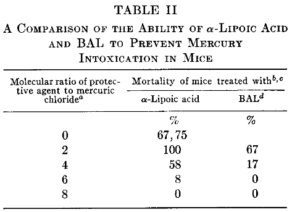
a) Quecksilberchlorid, das subkutan in einer Menge von 20 mg/kg Körpergewicht injiziert wurde. b) Schutzmittel, das intraperitoneal zum Zeitpunkt der Quecksilberintoxikation in Form einer frisch zubereiteten neutralen isotonischen Kochsalzlösung injiziert wurde. c) Die prozentuale Sterblichkeit, die innerhalb eines Zeitraums von 12 Tagen bei 12 Mäusen pro Gruppe beobachtet wurde. d) Britisches Anti-Lewisit; 2 ,3-Dimercaptopro- panol (BAL). Quelle:
Eine wichtige, aber über 60 Jahre alte Studie, welche auch Cutler anführt[AC9] ist die von Grunert [27]. Grunert berichtet über 4 wesentliche Erkenntnisse in Bezug auf ALA, wobei ich zwei hier wieder geben mag:
- a) wirksam zur Vorbeugung und Umkehrung einer Arsenvergiftung bei Mäusen und Hunden ist;
- b) wirksam die Quecksilbervergiftungen bei Mäusen verhindert, sofern ein ausreichend große Dosis verwendet wird.
So wurde auch festgestellt, das wenn das Verhältnis von ALA zu Quecksilber (bei Akutbelastungen) niedrig war (2: 1), die Toxizität nicht nur nicht verhindert, sondern sogar erhöht wurde. Warum das so war, blieb offen. Allerdings wurde diese Problematik unter verschiedenen Bedingungen gefunden und war reproduzierbar (deepl.com):
„Die erhöhte Toxizität von Quecksilber für Mäusen, wenn die Tiere mit nur 2-3 molaren Äquivalenten a-Liponsäure behandelt wurden, wurde wiederholt beobachtet. Nicht nur war die Sterblichkeit erhöht, sondern die Mehrheit der Todesfälle solcher Mäusen trat während der ersten 24 Std. auf und nicht erst in den zweiten 24 h. (Tabelle III).“
Sehr wichtig fand ich jedoch zwei Aussagen der Veröffentlichung [27] (Deepl.com):
„Obwohl nicht getestet, wären häufige Behandlungen mit einem niedrigen Verhältnis von Alpha-Liponsäure zu Quecksilber wahrscheinlich genauso wirksam wie das hohe Verhältnis, um den für den Schutz notwendigen Blutspiegel von Alpha-Liponsäure aufrechtzuerhalten.“
und:
„Tatsächlich fand Donatelli (5) bei Meerschweinchen heraus, dass die Verabreichung einer äquimolaren Menge Alpha-Liponsäure dreimal täglich in Abständen von 4 Stunden während der ersten 4 Tage die Tiere vor einer akuten Quecksilberintoxikation schützte.“
was für mich ein Hinweis darauf ist, das nicht nur die Einzeldosis, sondern auch die zeitliche Abfolge der Einzeldosen relevant ist. So schreibt auch Rooney [7] (Deepl.com):
„Während es den Anschein hat, dass ALA ein Potenzial als Quecksilberchelator haben könnte, geht aus den Arbeiten von Donatelli (1955) und Grunert (1960) auch hervor, dass die Wirkung von ALA auf die Quecksilbertoxizität von der Dosierungsgröße und dem zeitlichen Abstand der Dosierungen abhängt.„
Leider scheint Donatelli, von dem ich die originale Veröffentlichung auf einem Symposium in Neapel (1955) nicht ausfindig machen konnte, einer der sehr wenigen zu sein, der die zeitlichen Aspekte bei der Gabe von ALA untersuchte bzw. thematisierte.
Was mache ich nun aus dieser Studie? Zu geringe Dosen von ALA scheinen (bei Akutvergiftungen) nicht hilfreich zu sein und die zeitliche Abfolge (bei geringen Dosen) spielt anscheinend eine Rolle. Auch hier kann sicher in viele Richtungen argumentiert werden. Allerdings, und hier liegt der Knackpunkt: Es handelt sich wieder um Akutvergiftungen und Einmal- bzw. Kurzzeitgaben von ALA. 20 mg / Kg Körpergewicht Quecksilber und bis zu 8-fache Mengen an ALA (160 mg / Kg Körpergewicht) sind zudem keine kleinen Dosen. Umgerechnet auf einen 70 Kg schweren Menschen wären dies ca. 1,4 g Quecksilber und über 10 g Alpha-Liponsäure. Das sind Extreme! Was dieses für chronische Belastungen, Dauergaben von RS- ALA, R-ALA und die Gehirngesundheit eines Menschen bedeutet ist und bleibt auch hier unklar.
Studie von Geir Bjørklunda et al. (2019): ALA als Pro-Oxidant & Nrf2-‚Upregulator‘
Bjørklunda et al. [4] weisen in Ihrer Arbeit aus 2019 u.a. noch mal auf Patrick [8] hin und fassen dort geschriebenes folgend zusammen (deepl.com):
„Das Potenzial von α-LA, der Hg-Toxizität entgegenzuwirken, hängt grundlegend mit der Fähigkeit der Zellen zusammen, ihre stressreagierende Maschinerie zu aktivieren„
Damit meinen Bjørklunda & Co. die u.a. über Nrf2 induzierten Mechanismen und die Wirkung von ALA als Pro-Oxidant:
„α-LA und DHLA reagieren mit verschiedenen freien Radikalen, die sich dadurch auszeichnen, dass sie ein ungepaartes Elektron besitzen oder schnell instabile und extrem reaktive Spezies bilden. Die entstehenden Thiol-Radikale sind sehr kurzlebige Spezies und daher schwer nachzuweisen, obwohl bestätigende Beobachtungen mit Elektronenspin-Resonanz durchgeführt wurden. Thiol-Radikale können mit DHLA-Radikalen reagieren und dabei α-LA und DHLA umgestalten. Diese Radikale sind besonders an der ROS-Homöostase und der ROS-Signalgebung beteiligt.„
In diesem Beitrag möchte in jedoch auf das Thema Nrf2 nicht weiter eingehen, da ich dieses bereits im Detail in meiner Nrf2-Serie besprochen und dargelegt hatte.
Perspektiven von Greg (Biotoxin Journey) und Patrik Askert (Medical Insider) zu (R-)ALA
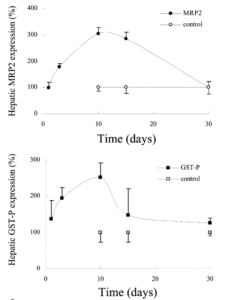
St. Johns Worth induziert eine vorübergehende Überexpression der hepatischen MRP2, GST-P. Die MRP2-, GST-P-Spiegel sind
ausgedrückt als Prozentsatz der Gesamtmenge an immunreaktivem
Proteins im Vergleich zur Kontrollbehandlung. Quelle: [2]
Auch Greg hat versucht, Studien zu finden, die die Ausscheidung von ALA, welches in irgendeiner Form an Schwermetalle gebunden ist, in vivo aufzeigen – fand jedoch ebenfalls nichts konklusives. Stattdessen konnte er nur Studien finden, die zeigen, dass ALA den Körper dazu veranlasst, mit dem „Aufräumen“ zu beginnen. Auch er kam zu dem Schluss, dass die R-Liponsäure (R-ALA) einen oxidativen Stress auslöst, auf den der Körper reagiert, indem er die Phase-II-Entgiftung (also u.a. die GSH-Systeme) hochfährt. (Anm H.C..: Nrf2-Induktion)
Greg schreibt weiter, dass wenn ALA nun jedoch nur die GSH-Basierende körpereigene Entgiftung ‚ankurbelt‘ und sich nicht (oder nur untergeordnet) an Metalle bindet (Anm. H.C.: diese Cheliert), dann müsste sich eine Person nicht unbedingt um die Halbwertszeit von ALA kümmern um den Spiegel hoch zu halten. In diesem Fall wäre die eigentliche Frage, wie lange das körpereigene Entgiftungssystem nach der Einnahme einer bestimmten Menge ALA hochreguliert bleibt. Leider hat Greg dazu nichts gefunden und auch Chris Shade äußert sich, bis auf die Studie mit Johanniskraut & Nrf2 [2], auch nicht dazu. Aus letzterer Studie und aus einer anderen [21] wird aber transparent, das die Erhöhung der Expression der antioxidativen Enzyme bzw. Systeme eine Sache von Tagen ist – nicht Minuten oder wenigen Stunden. Unmittelbar wirkt ALA wohl eher als Co-Faktor und Redoxpartner, wie ich weiter oben dargelegt habe und es die Studie & Messungen von Gregus et al. [1] vermuten lassen.
Zwar kommt Gregus zu dem Schluss, das es so aussieht, dass der Hauptwirkmechanismus von ALA darin besteht die Entgiftung zu beschleunigen (-> Nrf2) – jedoch denkt er, dass es in der Praxis sinnvoll ist ALA häufiger (jedoch ggf. geringer) zu dosieren.
Askert (Medical Insider) schreibt, das R-ALA ein Cofaktor bei der Energieproduktion (-> Mitos) ist und hilft, den Glukosestoffwechsel zu regulieren und beim Recycling von Glutathion zu helfen – was Leser meines Teil 1 zu ALA wissen. Askert weist darauf hin, dass ALA auch den Effekt hat, sich mit Schwermetallen zu verbinden und sie aus den Zellen und über die Blut-Hirn-Schranke (BBB) zu transportieren (beide Wege!) und das abhängig von den relativen Konzentrationen der Schwermetalle im Körper und im Gehirn – wie es auch Cutler schreibt.
Askert schreibt weiter, das er R-ALA erst recht spät in seinem Entgiftungs- und Chelatbildungsprogramm ausprobiert hat. Nach seinen bisherigen Beobachtungen scheint es jedoch äußerst wirksam zu sein, wenn es in ausreichender Dosierung eingenommen wird, wobei er 800-900 mg R-ALA angibt, aber nicht die Verteilung dieser Dosis über den Tag sowie eingehaltene Abstände. Er schreibt dann jedoch, das eine viel niedrigere Dosierung wahrscheinlich angemessener sein, z.B. 50-100 mg auf einmal und dann langsam ansteigend. Er weist jedoch auch darauf hin, das ALA, wenn noch eine signifikante toxische Metallbelastung im Körper vorliegt, insbesondere mehr im Körper als im Gehirn, dazu führen kann, das man sich noch kränker fühlt (bzw. wird). Für letzteren Fall weist er auf das Vorgehen von Cutler mit Kleistdosen ‚rund um die Uhr‘ in Verbindung mit einem klassischem Chelator (z.B. DMPS) hin.
Mein Fazit ist: Auch Greg & Askert sind sich einig, das ALA ‚etwas macht‘ – wobei ich eher zur vorsichtigen Herangehensweise von Askert tendiere. Im Vergleich dazu hatte Greg wohl hauptsächlich eine Schimmel-Belastung, wo dann das Problem der Mobilisierung von Quecksilber untergeordnet ist und höhere Dosierungen von (R-)ALA besser vertragen werden.
Mein Fazit
Weiterhin ist alles möglich, denn aus meiner Sicht belegen die von Cutler angeführten Studien nicht zu 100%, das ALA ein in vivo Hg2+ Chelator ist. Die Studien legen zwar die Vermutung nahe, speziell die von Gregus wo ein an GSH verarmtes Versuchstier (durch DEM) dosisabhängig zu ALA mehr Hg2+ in der Galle hatte. Dies starke Indiz für Cutlers Ansichten, denen ich Folge, welche zudem Shake in Bezug auf Hg2+ zu widerlegen scheinen, reicht mir jedoch nicht als „100%“ Beweis, wobei es sehr plausibel erscheint, das dem so ist. Denn: Keiner hat je die DHLA-Hg2+-Komplexe in der Galle nachgewiesen oder danach geschaut. Bis auf Leskova et al. sind zudem alle Studien reine Kurzzeit-Studien mit recht aktuellen Hg-Intoxikationen. Ob ALA wirklich über die Blut-Gehirn-Schranke (BHS) auch MeHg und Hg2+ chelieren kann, oder dies auf anderen Mechanismen beruht, ist für mich deswegen ebenfalls nicht zu 100% geklärt.
Sehr irritierend ist zudem die Studie von Grunert et al. (1960) für mich, in der geringen Dosen von ALA tödlicher waren als sehr hohe. Allerdings waren die ALA-Dosen schon ‚extrem‘, wie auch die vom Quecksilber. Auch, und das ist wichtig, geht es hier wieder um Akutbelastungen. Welche Lehren aus der Studie von Grunert zu ziehen sind ist so für mich unklar. Relevant ist für ich jedoch Grunerts Hinweis auf Donatelli. Die Aussagen von Donatelli , die leider nicht im Original zu überprüfen sind, legen nahe, das die zeitliche Komponente bei der Gabe von ALA relevant ist.
Die hier vorgestellte Thematik bewegt aktuell denn auch die Co-Autorin von Cutlers 2019er Buch, Frau Rust Lee, welche in verschiedenen Blog-Beiträgen [19][20][21] in Antwort auf Shade [18] versucht die Sach- und Fachlage aus Sicht des verstorbenen Cutler aufzuklären: a) das DHLA ein Hg-Chelator sei und b) das Glutathion kein effektiver Hg-Chelator ist.
Allerdings, und dies sollte dem aufmerksamen Leser dieses 2ten Teils zu dieser Frage klar geworden sein, scheint die Frage ob ALA ein direkter Hg-Chelator ist, nicht so einfach zu beantworten zu sein. Die Argumente von Frau Rust Lee und dem verstorbenen Cutler möchte ich deswegen in einem 3ten Teil zusammenfassen und im Kontext der hier und vorab vorgestellten Informationen und Erkenntnisse diskutieren.

Quicksilver-Produkte: Detox-Qube Basic mit Glutathion und R-ALA
Klar stellen möchte ich zum aktuellen Zeitpunkt jedoch auch, das Shade zwar Cutlers Schlussfolgerungen kritisiert bzw. in Frage stellt – seine eigenen Hypothesen jedoch auch nicht „Ende-Zu-Ende“ (Zelle -> Stuhl) mit in vivo Studien belegen kann. Das was Shade im Stuhl nach Gabe von liposomalem R-ALA misst könnte so auch das Resultat der Chelierung nach Cutler sein – wobei es durch die unregelmäßige Gabe von Shade’s R-ALA auch zu massiven Umverteilungen von Hg im Körper kommen könnte.
Aus letzterem Grund habe ich Shade seinen Weg auch nie selber ausprobiert und meinen „Detox-Cube“ letztendlich entsorgt, weil mir mein persönliches Risiko einfach zu hoch war mit größeren Gaben von R-ALA, abseits der pharmakologischen Halbwertzeit, zu experimentieren. Wer Erfahrungen mit R-ALA bzw. Shade seinen Produkten und dem Detox-Qube hat – mag sich jedoch gerne bei mir, für einen Erfahrungsaustausch, melden.
Links / Quellen
- [1] Effect of lipoic acid on biliary excretion of glutathione and metals., Gregus Z, Stein AF, Varga F, Klaassen CD, Department of Pharmacology, University Medical School of Pecs, Hungary., Toxicol Appl Pharmacol 1992 May;114(1):88-96, doi: 10.1016/0041-008x(92)90100-7
- [2] St. John’s Wort (Hypericum perforatum) induces overexpression of multidrug resistance protein 2 (MRP2) in rats: a 30-day ingestion study, Y Shibayama et al., Food Chem Toxicol, 2004 Jun;42(6):995-1002., doi: 10.1016/j.fct.2004.02.012.
- [3] Zashchitnyi effekt amida lipoevoi kisloty pri eksperimental’nom merkurializme. [Protective effect of lipoic acid amide in experimental mercurialism], Leskova GE, Gig Tr Prof Zabol 1979 Jun;(6):27-30 (Teiltext)
- [4] Insights on alpha lipoic and dihydrolipoic acids as promising scavengers of oxidative stress and possible chelators in mercury toxicology, Geir Bjørklunda et al., Volume 195, June 2019, Pages 111-119, Journal of Inorganic Biochemistry, doi: 10.1016/j.jinorgbio.2019.03.019
- [5] A Review on Coordination Properties of Thiol-Containing Chelating Agents Towards Mercury, Cadmium, and Lead, Geir Bjørklund et al., Molekules, Molecules. 2019 Sep; 24(18): 3247., Published online 2019 Sep 6. doi: 10.3390/molecules24183247
- [6] Complexation of Hg2+ with α-lipoic and dihydrolipoic acids: study by differential pulse voltammetry on rotating Au-disk electrode and ESI-MS, E. Chekmeneva, J.M. Díaz-Cruz, C. Ariño, M. Esteban, Electroanalysis 22 (2010) 177–184., doi: 10.1002/elan.200900299
- [7] The role of thiols, dithiols, nutritional factors and interacting ligands in the toxicology of mercury, James P K Rooney, Toxicology, 2007 May 20;234(3):145-56., doi: 10.1016/j.tox.2007.02.016. Epub 2007 Mar 1.
- [8] Mercury toxicity and antioxidants: Part 1: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity, Lyn Patrick, Altern Med Rev, 2002 Dec;7(6):456-71. (PDF)
- [9] Lipoic Acid: The Antioxidant Chameleon, J. R. Pfaffly, Biosciences Department,The University of Iowa, Iowa City, IA 52242, February 22, 2001
- [10] The pharmacology of the antioxidant lipoic acid, Gerreke Ph.Biewenga et al., General Pharmacology: The Vascular System, Volume 29, Issue 3, September 1997, Pages 315-331, doi: 10.1016/S0306-3623(96)00474-0
- [11] The reactions of 1, 3-dimercaptopropane, lipoic acid, and dihydrolipoic acid with metal ions, Phyllis R.Brown, John O.Edwards, Journal of Inorganic and Nuclear Chemistry, Volume 32, Issue 8, August 1970, Pages 2671-2675, doi: 10.1016/0022-1902(70)80316-5
- [12] Alpha-lipoic acid as a dietary supplement: Molecular mechanisms and therapeutic potential, Kate Petersen Shay, Biochim Biophys Acta. 2009 Oct; 1790(10): 1149–1160., Published online 2009 Aug 4. doi: 10.1016/j.bbagen.2009.07.026
- [13] Vitamin C, Glutathione, Or Lipoic Acid Did Not Decrease Brain Or Kidney Mercury In Rats Exposed To Mercury Vapor, H. Vasken Aposhian, Daniel L. Morgan, H. L. Sam Queen, Richard M. Maiorino & Mary M. Aposhianm, Journal Journal of Toxicology: Clinical Toxicology Volume 41, 2003 – Issue 4, Pages 339-347, Published online: 06 Feb 2003, doi: 10.1081/CLT-120022000 (Kritik von Cutler: Nr. 1, Nr. 2)
- [14] Amalgam Illness: Diagnosis & Treatment: What You Can Do to Get Better, How Your Doctor Can Help You, Andrew Hall, Ph.D. Cutler , 1. Juni 1999
- [15] Heavy Metals, Biotoxin Journey, Greg, March 14, 2017
- [16] Detoxification Protocols, Medical Insider
- [17] Chelation: Harnessing and Enhancing Heavy Metal Detoxification—A Review, Margaret E. Sears, ScientificWorldJournal. 2013; 2013: 219840., Published online 2013 Apr 18. doi: 10.1155/2013/219840
- [18] Dr. Christopher Shade Interview on Heavy Metal Detoxification for Autism, Becky Davila, 05.12.2019
- During this interview, Dr. Shade discusses his heavy metal detox protocol in comparison to Andy Cutler Chelation.
- [19] The Chelation Wars, Episode One, Rebecca Lee, 21.12.2019
- [20] About the Chris Shade Interview, Rebecca Lee, 17.2.2020
- [21] Episode Three of „The Chelation Wars“. What exactly is Lipoic Acid, Rebecca Lee, 5.4.2020
- [22] Direct and indirect antioxidant properties of α-lipoic acid and therapeutic potential, Luc Rochett et al., Mol Nutr Food Res, 2013 Jan;57(1):114-25., doi: 10.1002/mnfr.201200608.
- [23] Stereochemistry, Pharmacokinetics & Metabolism: Toward a Comprehensive Mechanism of Action, David A. Carlson, Director of R&D, GeroNova Research, Inc (Referenzen)
- [24] A new method for the detection and characterization of α-lipoic acid mixed disulphides, Takeshi Ishii, Miyuki Wakabayashi, Taiki Mori & Tsutomu Nakayama, Free Radical Research, 44:4, 403-409, 2010 DOI: 10.3109/10715760903536331
- [25] Utilization of renal slices to evaluate the efficacy of chelating agents for removing mercury from the kidney, R.L. Keith et al., Toxicology, Volume 116, Issues 1–3, 15 January 1997, Pages 67-75, doi: 10.1016/S0300-483X(96)03531-7
- [26] Regulatory effects of dihydrolipoic acid against inorganic mercury-mediated cytotoxicity and intrinsic apoptosis in PC12 cells, Kaniz Fatima Binte Hossain, ,Ecotoxicol Environ Saf, 2020 Apr 1;192:110238. doi: 10.1016/j.ecoenv.2020.110238. Epub 2020 Feb 6.
- [27] The effect of DL-alpha-lipoic acid on heavy-metal intoxication in mice and dogs, R R GRUNERT, Arch Biochem Biophys, 1960 Feb;86:190-4. doi: 10.1016/0003-9861(60)90402-1.
- [28] Lipoic acid impairs glycine conjugation of benzoic acid and renal excretion of benzoylglycine, Z Gregus et al., Drug Metab Dispos, 1996 Jun;24(6):682-8.
- [29] Lipoic Acid: Energy Production, Antioxidant Activity and Health Effects (Oxidative Stress and Disease), Mulchand S. Patel, Lester Packer, CRC Press, Year: 2008, ISBN: 1420045377
- [30] (R)-alpha-lipoic acid reverses the age-associated increase in susceptibility of hepatocytes to tert-butylhydroperoxide both in vitro and in vivo, T M Hagen 1 , V Vinarsky, C M Wehr, B N Ames, Antioxid Redox Signal, Fall 2000;2(3):473-83., doi: 10.1089/15230860050192251.
- [31] Effect of Nrf2 activators on release of glutathione, cysteinylglycine and homocysteine by human U373 astroglial cells, Megan L.Steele, Redox Biology, Volume 1, Issue 1, 2013, Pages 441-445
- [32] Protective effect of lipoic acid against oxidative stress is mediated by Keap1/Nrf2-dependent heme oxygenase-1 induction in the RGC-5 cellline, Yoshiki Koriyama, Brain Res, 2013 Mar 7;1499:145-57., doi: 10.1016/j.brainres.2012.12.041. Epub 2013 Jan 4.
- [33] Alpha-lipoic acid: Molecular mechanisms and therapeutic potential in diabetes., Rochette, Luc & Ghibu, S. & Muresan, Adriana & Vergely, Catherine., Canadian journal of physiology and pharmacology, 93. 1-7., 2015, DOI: 10.1139/cjpp-2014-0353
Vorträge von Chris Shade
- [CS1] Ask Dr Shade- Open Forum for Questions from our Community, Chris SHade, Ph.D., Quicksiver Scientific, 2015
Konversationen von Andy Hall Cutler (Bearbeitete und zusammengefasste Auswahl aus 26 Kommentaren von Cutler bei Onibasu)
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare