Eisen-Update Teil 2: Eisen-Mangel-Anämie bei hohem Ferritin (Serum) durch chronische Entzündungen (↑IL-6), Adipositas (↑Leptin) und ↑Hepcidin
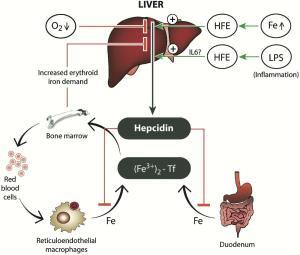
Die Rolle von Hepcidin, HFE und anderen Molekülen bei der Regulierung der systemischen Eisenhomöostase. Lizenz: CC BY NC ND 3.0, Autoren: [9]
Vorab: Bei einem entzündlich bedingten funktionalem Eisenmangel (ohne extra Eisenverluste, z.B. im Darm) ist das Serum-Ferritin eher normal-höher und der Hb-Wert kann niedriger ausfallen. Eisen ist genug da, nur bleibt es a) in den Zellen und wird b) nur reduziert aus dem Darm aufgenommen. In diesem Artikel geht es also nicht um einen realen Mangel an Eisen (mit u.a. niedrigem Serum-Ferritin), sondern um in der Regel eher normale oder hohe Serum-Ferritin Werte bei gleichzeitiger Anämie.
Folgende Themen ergeben sich für mich aus a) und b), wobei es in den Abschnitte „pragmatischer“ zugeht, also die vielen Abkürzungen vermuten lassen 😉
- Wie (chronische) Entzündungen (und Krankheiten) einen funktionalen Eisenmangel (ACD) erzeugen können.
- Das Bild zur Regulation des Eisenstatus via Hepcidin, Eisenstatus (BMP/SMAD) und IL-6/Zytokinen (JAK/STAT3)
- Welche Umstände führen zu höherem Hepcidin?
- Der JAK/START3 Signalweg: IL-6 und Leptin -> Adipositas -> Fettleibigkeit
- Inflammatorische Zytokine, speziell Interleukin-6 (IL-6): Das Schlüssel-Zytokin
- Aktivierte M1 Makrophagen: Machen IL-6, aktiviert über INF-γ und die NF-κB->TNF-alpha Kaskade
- Der BMP/SMAD-Signalweg: u.a. Eisenstatus, HFE
- Zusammenfassung in Bezug auf die Hepcidin erhöhenden Faktoren
- Was bedeutet ein chronisch hohes Hepcidin für andere eisenrelevante Blutwerte?
- Einschub: Wie Nierenleiden (u.a. CKD) über reduzierte EPO- (Erythropoetin) Produktion zu geringen Hb-Werten führen
- Ein Ausblick auf die Diagnose von chronischen Entzündungen bei hohem Hepcidin
In jedem Falle sind folgende Maßnahmen bei vielen Arten von Eisenmangel potentiell hilfreich:
- Ein Ausblick auf Behandlungsmöglichkeiten zur Senkung von IL-6 und Hepcidin
- Möglichkeiten Darm-Probleme als Ursache von chronischen Entzündungen (aber auch Eisen-Mangel) zu lidern
Am Ende des Artikels folgt dann mein übliches Fazit. Für alle die an Serum-Ferritin interessiert sind, muss ich auf Teil 3 dieser Serie verweisen.
Hinweis: Hier geht es zum Eisen-Übersichtsartikel
Inhaltsverzeichnis für den Schnellzugriff
Wie (chronische) Entzündungen (und Krankheiten) einen funktionalen Eisenmangel (ACD) erzeugen können
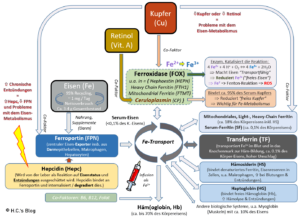
Mein großes Bild zum Eisen-Metabolismus.
In Eisen-Update Teil 1 hatte ich die Problematik bereits kurz angerissen:
- (Chronische) Entzündungen, bei denen u.a. (vermehrt, ↑) das Zytokin Interleukin 6 (IL-6) oder auch IL-1ß, z.B. von (M1) Makrophagen ausgeschüttet werden, haben zur Folge, das mehr Hepcidin produziert wird.
- Hohes Hepcidin reguliert die Menge an Ferroportin (FPN) herunter – „dem“ Eisen exportierendem Protein auf der Oberfläche von Zellen wie Enterozyten, Hepatozyten, Erythrozyten und Makrophagen.
- Ferroportin ist allerdings der einzige bekannte „Eisenexporteur“ [14], der dazu dient, Eisen aus dem Zellinneren, u.a. den Speichern sowie dem Darm, in das Plasma zu transportieren.
Das bedeutet: Hepcidin steuert über Ferroportin die Eisenkonzentration im Blutkreislauf:
↑ Mehr Hepcidin => ↓ weniger Ferroportin => ↓ weniger (bio-) verfügbares Eisen.
Meint: Durch die Herabregulierung von Ferroportin reduziert ein (durch Entzündungen) hohes Hepcidin den Export von Eisen-Ionen aus Duodenalenterozyten (Darm), also die Eisenaufnahme aus dem Darm, sowie aus Makrophagen (Fresszellen), Hepatozyten (Leberzellen), u.a. dem RES (retikuloendothelialem System) und anderen Zellen. Das RES hatte ich im Eisen-Update Teil 1 vorgestellt.
Hintergrund: Die Erhöhung des Hepcidin-Spiegels bei Entzündungszuständen (und damit die Senkung des Serumeisenspiegels), hat sich wohl als Abwehrmechanismus gegen eindringende Krankheitserreger entwickelt, da Eisen ein Co-Faktor für die Vermehrung bzw. das Wachstum einiger pathogener Erreger und Mikroorganismen ist. Da Hepcidin hauptsächlich in der Leber produziert wird, trug diese auch zu seinem Namen bei: „Hep“ (Leber) und „cidin“ wegen der Ausschüttung im Kontext der mikrobiziden Aktivität. Das ganze ist also grundsätzlich ein guter Mechanismus. Aber eben nicht, wen dieser chronisch wird! Deswegen nennt man einen dadurch produzierten (funktionalen) Eisenmangel auch Anämie Chronischer Krankheiten (ACD).
Natürlich gibt es neben IL-6 und Entzündungs-Zytokinen noch andere Regelmechanismen für Hepcidin, wie den Eisen-Status (-> Mangel, Überschuss, o.k.) und den Bedarf für die Erythropoese, also die Bildung roter Blutkörperchen, welche z.B. über EPO (Erythropoetin), das von der Niere ausgeschüttet wird, gesteuert wird.
Das Bild zur Regulation des Eisenstatus via Hepcidin, Eisenstatus (BMP/SMAD) und IL-6/Zytokinen (JAK/STAT3)
Zur besseren Übersicht der Hepcidin-Regulation „habe ich mal ein Bild gemalt“. Natürlich ist auch dieses Bild nur eine kompliziertere Vereinfachung der Realität – aber immerhin 😉
Folgendes ist hier zu sehen: Das hepatische Hormon Hepcidin ist der zentrale Regulator der systemischen Eisenhomöostase.
- Die Expression des Gens HAMP (Hepcidin Antimicrobial Protein), das für Hepcidin kodiert, wird auf transkriptioneller Ebene
- durch den Eisen-Status (u.a. Überschuss oder Mangel) über den BMP/SMAD-Signalweg (-> Knochen- (Bone-) morphogenetisches Protein/mothers against decapentaple),
- durch entzündliche Zytokine wie IL-6, u.a. freigesetzt aus M1 Makrophagen) über den JAK/STAT3-Signalweg (-> Janus-Kinase/Signal Transducer and Activator of Transcription 3)
- und durch die erythropoetische Nachfrage (-> „Rote Blutkörperchen“) reguliert.
Natürlich wirken über diese Signalwege auch noch andere regulatorische Faktoren, wie z.B. HIF-1α, das bei einer Hypoxie (-> Sauerstoffmangel) ausgeschüttet wird. Komplex wird es, wenn gegensätzliche regulatorische Faktoren zusammenkommen, weil hier die Studienlage dünn ist.
Zusammenfassung:
- Während Eisenüberschuss und Entzündungen die Expression von Hepcidin erhöhen,
- u.a. bei rheumatische Erkrankungen, entzündliche Darmerkrankungen, chronische Infektionen, multiplem Myelom [31]
- bewirken Eisen- und Sauerstoff-Mangel, ein gesteigerter erythropoetischer Bedarf für eine Unterdrückung von Hepcidin,
- und bei einem Eisen-Mangelanämie (IDA) auch unabhängig vom Entzündungs-Status [25][31],
- wobei Hepcidin sogar bis auf „0“ (nicht nachweisbar) supprimiert werden kann, wenn (Speicher-) Eisen fehlt.
Interessanter Weise ist Hepcidin auch bei β-Thalassämie dauerhaft niedrig und trägt so zur Problematik bei [31], weil unentwegt Eisen akkumuliert und aus Speichern freigesetzt wird.
Welche Umstände führen zu höherem Hepcidin?
Diese Frage stelle ich mir, weil ein chronisch hohes Hepcidin zu einem funktionellen Eisenmangel führen kann. Wie im vorherigen Bild zu sehen, wird Hepcidin über [9][10][14]:
- den JAK/START3 Signalweg (-> Janus-Kinase/Signal Transducer and Activator of Transcription 3),
- hier insbesondere über das Zytokin Interleukin-6 (IL-6) [11][12],
- was insbesondere auch von aktivierten M1 Makrophagen (M1-M) ausgeschüttet wird, sowie
- den BMP/SMAD-Signalweg (-> Knochen- (Bone-) morphogenetisches Protein/mothers against decapentaple) aktiviert.
Wichtig: Störungen der Hepcidin-Expression (-> meist Gen-Polymorphismen) der (Gen-) Transkription von HAMP, werden grundsätzlich mit verschiedenen Krankheiten in Verbindung gebracht. Darunter Eisenüberladung, wie die hereditäre Hämochromatose, sowie Anämie bei besagten Entzündungen. Folgend konzentriere ich mich jedoch auf die (potentiell) wichtigsten ’normalen‘ Faktoren, welche über Punkt 1.-4. ein hohes Hepcidin befördern können.
Der JAK/START3 Signalweg: IL-6 und Leptin
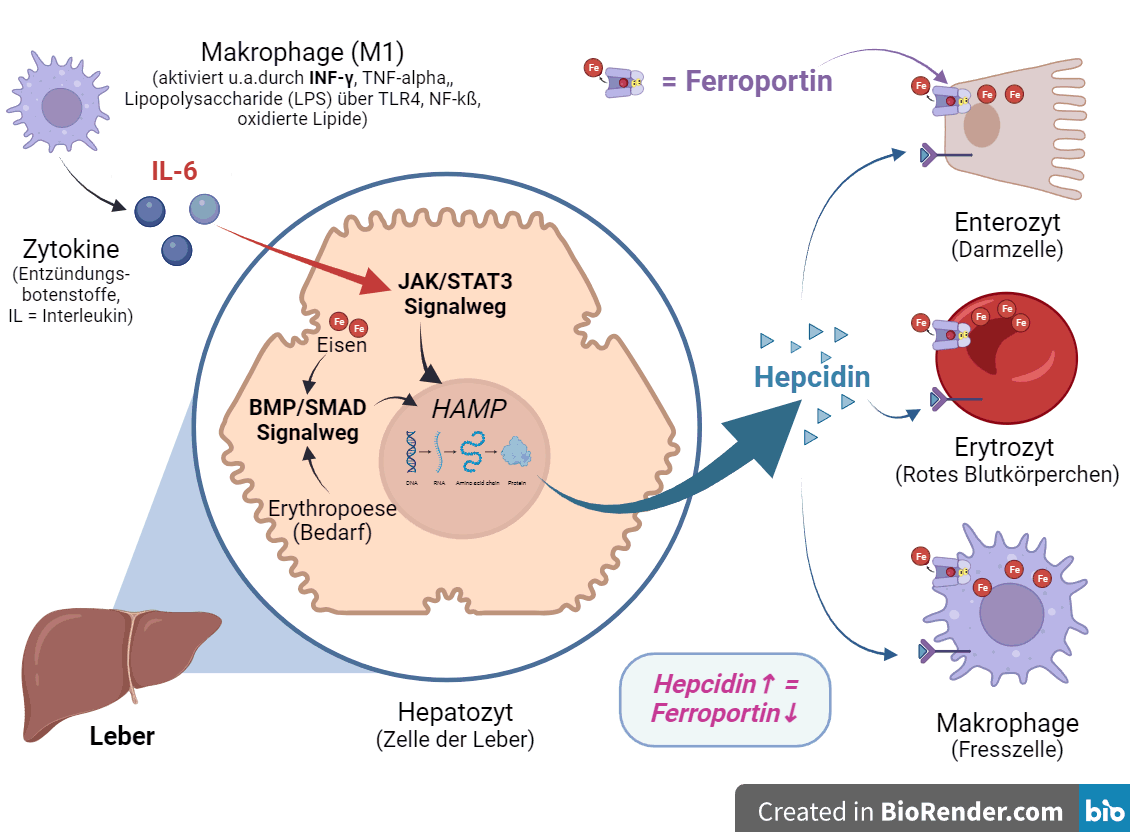
 Der Signalübertragungsweg der Januskinase (JAK) / Signal Transducer and Activator of Transcription 3 (STAT3) wird durch verschiedene Faktoren und Ereignisse reguliert. Die wichtigsten Faktoren, welche ein hohes Hepcidin befördern, sind:
Der Signalübertragungsweg der Januskinase (JAK) / Signal Transducer and Activator of Transcription 3 (STAT3) wird durch verschiedene Faktoren und Ereignisse reguliert. Die wichtigsten Faktoren, welche ein hohes Hepcidin befördern, sind:
- Interleukin-6 (IL-6): ist einer der prominentesten Aktivatoren des JAK/STAT3-Signalwegs.
- Es bindet an seinen spezifischen Rezeptor (IL-6R), was zur Aktivierung der JAK führt.
- Diese phosphorylieren dann STAT3, was dessen Dimerisierung, Kerntranslokation und Aktivierung der Zielgene zur Folge hat.
- Zu viel Leptin, ein Hormon, das vor allem von Fettzellen freigesetzt wird, kann ebenfalls den Signalweg aktivieren. [12][29]
- Adipozyten sezernieren proinflammatorische Adipokine und Zytokine, wie Adiponektin, Leptin, Resistin, PAI-1, TNF-α, IL-6, CRP und weitere Zytokine, die an der Insulinresistenz beteiligt sind [25].
- Eine inhärente Folge der Adipositas trägt zu einer erhöhten „Porosität“ der Darmwand bei, zur Durchlässigkeit des Darms und Anstieg der Lipopolysaccharide (LPS)
- im Blut, sowie der Aktivierung von Toll-ähnliche Rezeptoren (TLRs) und Entzündungen (-> IL-6) führt. [25]
Anzumerken ist, dass nicht alle IL’s inflammatorisch sind. Interleukin-10 (IL-10) ist z.B. anti-inflammatorisch und wirkt ggf. senkend auf Hepcidin. Die Regulation des JAK/STAT3-Weges ist deswegen komplex und kontextabhängig, so dass, keine Angst, ich dieses Thema hier nicht weiter vertiefen werde 😉
Inflammatorische Zytokine, speziell Interleukin-6 (IL-6): Das Schlüssel-Zytokin
Hinweis: Der nächste kurze Abschnitt ist nur für die Freunde des Blogs sichtbar.
Aktivierte M1 Makrophagen: Machen IL-6, aktiviert über INF-γ, + die NF-κB->TNF-alpha Kaskade
Hinweis: Der nächste kurze Abschnitt ist nur für die Freunde des Blogs sichtbar.
- Lipopolysaccharide (LPS): LPS sind Bestandteile der Zellwand gramnegativer Bakterien, und oft auch bei einer Fehlbesiedlung des Darms anzutreffen.
- LPS bindet an Toll-ähnliche Rezeptoren (TLR) auf Makrophagen, insbesondere TLR4,
- was zur Aktivierung des NF-κB-Signalwegs und Makrophagen und
- in Konsequenz zu mehr Hepcidin führt [18].
- Tipp: Über TLR’s hatte ich in diesem Beitrag schon etwas geschrieben.
- Wichtig: Durch die Entzündungen bei LPS kan es auch zu zusätzlichen intestinalen Eisenverlusten kommen, welche mittel oder langfristig zu einem realen Eisenmangel (IDA) führen.
- „Leaky Gut“ (durchlässiger Darm) bzw. allergene Reaktionen auf Nahrungsmittelbestandteile durch einen „Leaky Gut“: TLR’s können auf Nahrungsmittelbestandteile im Blut reagieren, die dort nicht hingehören.
- Hier wird dann ebenfalls der NF-κB-Signalweg aktiviert.
- Wichtig: In der Regel ist die Eisenabsorption hier zusätzlich vermindert und es kann auch zu (okkultem) Blutverlust kommen, wodurch noch mehr Eisen verloren geht. Mittel- oder langfristig kann es hier also zu einem realen Eisenmangel (IDA) kommen.
- Tumornekrosefaktor (TNF-alpha): kann ebenfalls zur Aktivierung von M1 Makrophagen beitragen, insbesondere in Verbindung mit anderen Signalen wie IFN-γ.
- NF-κB aktiviert dabei TNF-alpha,
- womit sich für mich der Kreis in Bezug auf LPS und „Leaky-Gut“ als Auslöser von mehr IL-6 schließt.
Interessant mag sein, das klassisch aktivierte „M1“ Makrophagen auch die induzierbare Stickstoffmonoxid-Synthase (iNOS) hochregulieren, welche mehr NO „macht“, was bei chronischer Aktivierung und oxidativen Stress „sonstwo im Körper“ auch zu mehr Peroxinitrid (ONOO) beiträgt. Gut für den kurzen Infekt, ungut, wenn dies chronisch passiert. Mehr Peroxinitrid macht aber wiederum mehr nitrosativen Stress, der reguliert wiederum die Zytokine, NK-kB und Konsorten hoch. Ein Teufelskreislauf!
Der BMP/SMAD-Signalweg: u.a. Eisenstatus, HFE
Als letzter Aspekt ist noch der Bone Morphogenetic Protein (BMP)-Signalweg direkt an der Regulation der Hepcidin-Expression beteiligt, vor allem als Antwort auf Änderungen im Eisenstatus des Körpers. Folgend liste ich einige Faktoren und Mechanismen aus, welche über den BMP/SMAD-Signalweg die Hepcidin-Transkription erhöhen:
- Eisenstatus: Erhöhte Spiegel im Körper fördern BMP (insb. BMP6), niedrige Eisen-Spiegel wirken nicht erhöhend auf Hepcidin.
- HFE (Hereditäres Hämochromatose-Protein), Transferrin-Rezeptor 2 (TfR2) und Hemojuvelin (HJV) sind wichtige Modulatoren des BMP/SMAD-Signalwegs.
- Mutationen in diesen Proteinen sind mit hereditärer Hämochromatose (-> abnormale, vermehrte Ablagerung von Eisen) verbunden.
- ggf. auch IL-6 und andere pro-inflammatorische Zytokine, wobei Art und Weise, Interaktionen und Umfang hier weniger klar sind als bei JAK/STAT3.
Zudem wirken Regulatoren wie erhöhtes Erythroferron (ERFE) über BMP als negativer Regulator von Hepcidin, u.a. während erhöhter Erythropoese (-> Blutbildung, rote Blutkörperchen), wie bei Anämie oder Hypoxie.
Zusammenfassung in Bezug auf die Hepcidin erhöhenden Faktoren
Ergänzend können auch noch Lebererkrankungen verschiedene Mechanismen der Hepcidin-Ausschüttung beeinflussen. Gerade bei einer Leberzirrhose oder Hepatitis kann es zu einer Dysregulation der Eisenhomöostase kommen, was sich auch in veränderten Serum-Ferritin-Werten widerspiegeln kann. Hämatologische Erkrankungen und Entzündungen (MRT-Kontrolliert über die Leber) führen teils zu hohen Eisen-Anreicherungen in der Leber und Serum-Ferritin Werten > 1700 ng/ml. Allerdings sind teils noch normale Eisenkonzentrationen (in der Leber) bis 50 µmol/g Trockengewicht zu messen [32]. Nichts ohne Ausnahmen.
Ebenfalls können einige maligne Erkrankungen (-> Krebs) den Eisenstoffwechsel beeinträchtigen, da Tumorzellen Zytokine freisetzen können, welche über Hepcidin die Freisetzung von Eisen aus den Speichern ebenfalls reduzieren.
Zusammenfassung: Aus meiner Sicht der Studienlage sind, neben dem Eisen-Status und erblichen Problemen primär IL-6 [1][9][10][11][14] für ein abnormal (chronisch) hohes Hepcidin und damit einen funktional gestörten Eisen-Stoffwechsel (u.a. ACD) verantwortlich, solange kein realer Eisenmangel vorliegt, denn dann wird Hepcidin, unabhängig von IL-6, etc. herunterreguliert um anscheinend „zu mobilisieren was geht“.
Zu allem kommt noch ein hohes Leptin [12] aus (adipösen) Fettzellen [25], welche auch IL-6 und anderen inflammatorische Faktoren freisetzten [19][29].
Krebs, Gen-Polymorphismen (z.B. HFE-Gen) sowie die unterschiedlichen Lebererkrankungen sind alles wichtige Themen, jedoch so vielschichtig, das ich diese hier nicht weiter im Detail behandle. Einige der Darm-Erkrankungen können über (okkulte) Blutverluste jedoch doppelt schädlich wirken: Sie führen
- a) zu einem direkten Blut und damit auch Eisen-Verlust,
- b) regulieren jedoch gleichzeitig Hepcidin hoch, solange noch genug Eisen in den Speichern da ist, reduzieren damit die Eisenaufnahme über den Darm noch mehr,
- c) „sperren“ zudem Eisen in den Körperspeichern ein,
was aus meiner Sicht dazu führt, das mittelfristig, speziell über Jahre, es zu einem (realen) Eisenmangel und Anämie (IDA) kommt, wobei es zuerst ggf. nur einen funktionellen Eisenmangel mit chronischen Entzündungen (ACD) und mit noch relativ normalen (oder hohen) Serum-Ferritinwerten gibt.
Einschub: Wie Nierenleiden (u.a. CKD) über reduzierte EPO- (Erythropoetin) Produktion zu geringen Hb-Werten führen
Für Dysregulationen von Hb-Wert, Erythrozyten, zum Teil auch Hepcidin, kommt auch eine chronische Nierenerkrankung (CKD) in Frage. Daraus entsteht häufig eine Anämie, die durch verschiedene Faktoren bedingt sein kann:
- Verringerte EPO-Produktion: EPO, ein Hormon, das hauptsächlich in den Nieren produziert wird, spielt eine zentrale Rolle bei der Bildung roter Blutkörperchen (Erythrozyten). Bei CKD sind die Nieren oft nicht in der Lage, ausreichend EPO zu produzieren,
- was zu einer verringerten Produktion von Erythrozyten führt und
- somit eine Anämie verursacht.
- Erhöhte Hepcidinspiegel: sind bei CKD zu beobachten,
- da Entzündungsfaktoren hier auch eine Rolle spielen,
- sowie nicht genug EPO zur Verfügung steht, was über BMP/SMAD potentiell die Hepcidinspiegel senkt.
Letztendlich entsteht ein „funktioneller Eisenmangel“: Der Körper hat zwar genug Eisen, kann dies jedoch, wegen wenig EPO bzw. hohem Hepcidin, nicht effektiv nutzen. Zur Behandlung der Anämie bei CKD werden häufig EPO-Stimulatoren eingesetzt.
Was bedeutet ein chronisch hohes Hepcidin für andere eisenrelevante Blutwerte?
Die Hemmung der Eisenfreisetzung über ein hohes Hepcidin führt dazu, dass weniger Eisen für die Hämoglobin- (Hb-) Synthese und andere eisenabhängige Prozesse zur Verfügung stehen. Dies kann zu einem funktionellen Eisenmangel führen, bei dem die realen Eisenreserven des Körpers normal oder sogar erhöht sind. Diesen Fall gilt es von einem wirklichen Eisenmangel abzugrenzen.
Allerdings kann, wenn Hepcidin über lange Zeit erhöht, und die „Neu“-Eisenzufuhr aus dem Darm faktisch abgeschnitten bzw. stark reduziert ist, über die Dauer, zu einem realen Eisenmangel kommen. Ob das nun Monate oder Jahre dauert, oder überhaupt passiert, hängt von vielen Variablen ab. Anfällig wären hier u.a. Kinder, welche noch keine großen Eisen-Depots haben, sowie Frauen mit starker Regelblutung, sowie in der Schwangerschaft bzw. der Stillzeit. Wie weiter oben beschrieben sind auch okkulte Blutverluste über den Darm ein Problem (-> Parasiten, Crohn, etc.).
Insofern muss bei einer Eisenmangel-Anämie zwischen diesen beiden Fällen (-> IDA / ACD) unterschieden werden! Folgendes sollte bei einem funktionellen und realen Mangel in die gleiche Richtung tendieren:
- Hb, aber auch MCH, MCHC: Erniedrigt, wenn der (funktionale) Eisenmangel schon sehr akut ist.
- Serum-Eisen: Erniedrigt, wenn nicht Entzündungsbedingt erhöht.
- Transferrin: Kann leicht erhöht sein. Bei chronischen Entzündungsprozessen kann Transferrin als negatives Akutphase-Protein jedoch abnehmen [23].
- Transferrin-Sättigung (TfS): Es verhält sich umgekehrt zum Transferrin: Also leicht niedrig oder nach [23] erhöht.
Allerdings muss dies bei Leber-Zirrhose nicht so sein. Dort kann Hepcidin normalwertig sein, dafür sind jedoch die Lebert-Werte GOT, GPT und GGT erhöht, Transferrin gesenkt, TfS erhöht und Hb ebenfalls erhöht [23]. Kontext, Kontext, Kontext!
Die Ausnahme ist das Serum-Ferritin. Es korreliert nach Studienlage mit Hepcidin, weil dies das Eisen in den Speichern zurückhält [21][23][24][25]. Deswegen wird es in der Regel bei einem funktionellen Mangel durch chronische Entzündungen erhöht sein, weil es
- a) ein Akut-Phase Protein ist,
- b) mehr Eisen in den Ferritinen zurückgehalten wird und
- c) nach Kell et al. Serum-Ferritin ein Marker der zellulären Zerstörung („Leckage-Produkt“) ist, [6][7], was zu inflammatorischen Prozessen passt.
So schreiben Kell et al [6]:
„… korreliert der Ferritinspiegel im Serum mit zahlreichen entzündlichen und degenerativen Erkrankungen.“
Im Falle eines realen Eisenmangels sollte Serum-Ferritin jedoch stark erniedrigt sein, wenn nicht eine Entzündungssituation, wie Kell et al. es beschreiben, es erhöht, wobei mir unklar ist in wie weit diese Erhöhung ausfällt. Zudem gibt es auch den Blutwert des löslichen Transferrin-Rezeptos (sTfR) und dem darauf basierenden sTfR-Log-Ferritin-Index, welcher, neben Serum-Ferritin, zwischen einen realen und funktionellen Eisenmangel klar und frühzeitig differenzieren an. Beide sTfR-Marker sind erst erhöht, wenn es auch einen realen Speichereisen-Mangel gibt. Mehr dazu in Teil 4 dieser Serie.
Ein Ausblick auf die Diagnose von chronischen Entzündungen und hohem Hepcidin
Die Messung von Hepcidin (kompetitiver ELISA für Hepcidin aus Humanserum [20]) wird leider noch nicht in üblichen Laboren angeboten, weswegen andere Marker ausgewichen werden muss.
Wer den Abschnitt „Welche Umstände führen zu höherem Hepcidin?“ gelesen hat, wird erahnen können, das all die dort aufgeführten Aspekte zu einem höheren Hepcidin führen können. Allerdings darf wohl nicht zu indirekt gedacht werden, denn z.B. TNF-alpha erhöht (in Zellkulturen) Hepcidin nicht [10]. Zwar wirkt TNF-alpha indirekt über die M1-Makrophagen, aber die müssen a) in den Zellkulturen da sein und b) wenn Sie da sind, auch genug IL-6 ausschütten.
Der für mich sichere Weg wäre direkt auf erhöhtes IL-6 zu testen. Dazu aus einer Studie [10]:
„Unsere Studien an menschlichen Leberzellkulturen, Mäusen und menschlichen Freiwilligen deuten darauf hin, dass IL-6 das notwendige und ausreichende Zytokin für die Induktion von Hepcidin während einer Entzündung ist und dass die IL-6-Hepcidin-Achse für die Hypoferremie bei Entzündungen verantwortlich ist.
Weitere für mich sinnvolle Tests, soweit Indikationen vorliegen, dass dies der Fall sein könnte wäre z.B.:
- LPS (Lipopolysaccharide), z.B. mittels:
- Endotoxin Bestimmung im Serum (LPS), GanzImmun, Serum (Blut), EDV-Code: 9011
- Einen Darmcheck mit LPS Bestimmung, z.B. Darmcheck Mikrobiom, Stuhl, GanzImmun EDV-Code: 9826
- Leaky-Gut via:
- Zonulin und Alpha-1-Antitrypsin, z.B. Leaky-Gut Syndrom Plus, Stuhl, Serum (Blut), GanzImmun EDV-Code: 5649
- Wenn erhöht, dann ist die Chance einer durchlässigen Darmwand erhöht.
- Optional auch FABP2
- Kann nur im Blut nachgewiesen werden, wenn die Darmwand durchlässig ist.
- Zonulin und Alpha-1-Antitrypsin, z.B. Leaky-Gut Syndrom Plus, Stuhl, Serum (Blut), GanzImmun EDV-Code: 5649
- Für Endotoxine und Leaky-Gut:
- Optional auch sCD14
- Kann nur im Blut nachgewiesen werden wenn Endotoxine vorhanden sind und ggf. die Darmwand passiert haben.
- Optional auch sCD14
- Leptin bei adipösen Menschen oder BMI > 24
- Leptin (Serum)
- Wenn stark erhöht, dann chance, das dies BMP/SMAD aktiviert.
- Leptin (Serum)
- IFN-γ wäre, wenn Geld kein Thema ist, eine weitere Möglichkeit, da dies ja M1-Makrophagen aktiviert.
- IP10 (Serum), GazImmun, EDV-Code: 8284
- Hier wird meist IP10 gemessen, das aufgrund der höheren Stabilität gegenüber IFN-γ einen idealen Marker für die biologische Aktivität von IFN-γ darstellt.
- IP10 (Serum), GazImmun, EDV-Code: 8284
In Teil 3 werde ich diesen teil der Diagnostik etwas vertiefen. Ein kompetenter Therapeut kann aus den anderen Informationen, je nach Anamnese des Patienten ggf. noch andere Thematiken ableiten und entsprechende Untersuchungen anstellen sowie die Ergebnisse auswerten. Die Labore geben dazu dem Fachpersonal Zugang zu Lehrmaterial, was genau beschreibt was ein Wert bedeutet und wie die Ergebnisse der Untersuchungen zu deuten sind.
Ein Ausblick auf Behandlungsmöglichkeiten zur Senkung von IL-6 und Hepcidin
Grundsätzlich muss letztendlich immer die Ursache behandelt werden: Adipositas (-> Schilddrüse?), Darm-Dysbiosen, Probleme im Zahnbereich, etc. Die (kurzfristige) Alternative wäre die direkte Senkung von Hepcidin mittels pharmakologischer Mittel. Allerdings gibt es Stand 2023 noch keine dafür (zugelassenen) pharmakologischen Mittel welche Hepcidin direkt senken, jedoch (extrem teure) Mittel die JAK inhibieren und IL-6 senken.
Hinweis: Der nächste kurze Abschnitt ist nur für die Freunde des Blogs sichtbar.
Die probateste Variante bei einem funktionellen Eisenmangel mit hohem Serum-Ferritin scheint mir jedoch eine Reihe von Nahrungsergänzungsmittel, Arzneipflanzen und Vitalpilzen zu sein, die potenziell die IL-6-Produktion senken oder die IL-6-Aktivität modulieren können. In diesem Artikel gebe ich jedoch nur eine kurze Übersicht, ohne mich spezifisch im Zusammenhang mit IL-6 damit befasst zu haben, was nun genau bei welcher Diagnose hilfreich ist. Bromelain ist für mich jedoch ganz oben auf der Liste:
- Bromelain: Senkt TNF-alpha und IL-6
- Papain: Senkt TNF-alpha und IL-6
- Curcumin: Der aktive Bestandteil von Kurkuma, senkt IL-6 [30], NF-kB und TNF-alpha.
- Quercetin: Ein Flavonoid, das in vielen Pflanzen vorkommt, reduziert u.a. IL-4, IL-6, IL-8 und IL-13 sowie MCP-1 und COX-2.
- Magnesium: weil es für alles gebraucht wird 😉
Mehr Links auf Produkte finden sich in den vorhergehend verlinkten Artikeln. Nachfolgend noch Bromelain/Papain und eine Auswahl an NEM:
- Bromelain
- Doctor’s Best (3000 GDU, 500 mg, 90 vegetarische Kapseln) – Keine blöden Zusatzstoffe
- Life Extension( 2400 GDU, 500 mg, 60 magensaftresistente Tabletten) – Speziell beschichtetes Bromelain, leider blöde Zusatzstoffe.
- Hinweis: Kann den Magen passieren, ohne das Magensäure das Bromelain „Killt“. Je nachdem was man erreichen will.
- Papain
- Swanson (12.000 USP, 100 mg, 90 pflanzliche Kapseln) – leider mit Siliciumdioxid.
- Swanson (50 mg, 300 beschichtete Tabletten) – Speziell beschichtetes Papain, leider blöde Zusatzstoffe.
- Hinweis: Kann den Magen passieren, ohne das Magensäure das Papain „Killt“. Je nachdem was man erreichen will.
- NOW Foods (Enzym-Mix, 180 Lutschtabletten) — leider mit Siliciumdioxid, Papain-Bromelain, etc. Mix
- Curcumin
- Life Extension (Curcumin Elite CGM-Mischung, 500 mg, 60 vegetarische Kapseln) – der Klassiker, leider mit Siliciumdioxid
- Info: Nutzt anscheinend die CurQuofen Technologie mit reduzierter Partikelgröße
- Doctor’s Best (Curcumin Phytosome Meriva, 500 mg, 180 pflanzliche Kapseln) – leider mit Siliciumdioxid
- Info: Meriva gilt auch als eine sehr gute Form von Curcumin, ähnlich wie die von Life Extension
- Problem: Senkt wohl auch Eisen!
- Life Extension (Curcumin Elite CGM-Mischung, 500 mg, 60 vegetarische Kapseln) – der Klassiker, leider mit Siliciumdioxid
- Quercetin
- 50 mg enzymatisch modifiziertes Iso-Quercetin (Natural Factors, EMIQ) für angeblich bis zu 40-fach bessere Bioverfügbarkeit, ohne Siliciumdioxid
- 250 mg liposomal (Natural Factors, Quercetin LipoMicel Matrix) für angeblich bis zu 10 * besserer Resorption, ohne Siliciumdioxid
- Problem: Senkt wohl auch absorption von Eisen!
Hiweis: Bei den Curcumin-Extrakten ist mir selber das bisschen Silicium-Dioxid egal, denn die Produkte sind für mich gut.
Natürlich gibt es viele weitere Dinge, die IL-6 senken, insbesondere Lifestyle-Veränderungen und eine gute (fettarme) Ernährung. Das WLAN/Mobilfunk potentiell IL-6 [4] (und anderes) erhöht, würde ich von allem Funkendem, inkl. Schnurlostelefonen und Bluetooth, abstand halten.
Möglichkeiten Darm-Probleme zu lidern (u.a. auch beim niedrigem Eisen-Status bzw. niedrigem Ferritin)
Die Gabe von oralen Eisensupplementen bei hohem Hepcidin mit Darmproblematiken ist jedoch nicht unbedingt Erfolg versprechend und führt im schlechtesten Fall nur zu erhöhtem oxidativem Stress im Darm, einem ungünstigen Mikrobiom, ggf. dem Wachstum eines Darmkrebs und bei funktionellem Mangel zur weiteren Eisenüberladung des Gesamtsystems, wenn eine ACD vorliegt. Bei einem realen Eisenmangel ist dann auch oft der Darm das Problem, worauf ich in Teil 3 dieser Serie noch eingehen werde.
Folgendes könnte bei einer (wie auch immer gearteten) Darm-Problematik Hilfreich sein:
- Probiotika [25] – die „guten“ Darmbakterien,
- Präbiotika – welche gute Darmbakterien ernähren,
- Glutamin – die Aminosäure, die als Magen & Darm „Heiler“ bekannt ist,
- „Künstliche“ Magensäure – mittels Supplement über die Einnahme von Betain HCL zusammen mit dem Essen, alternativ Ascorbinsäure (Vitamin C).
- Buttersäure – für eine gute Darmflora,
- Mastix – gegen H. Pylori?,
- Effektive Mikroorganismen (EM) – für eine gute Darmflora.
Bei Darmproblemen bitte Vorsicht mit residenter Stärke! Die ernährt nicht nur gutes, sondern auch LPS – und das ist in diesem Fall nicht hilfreich. Diese Stärke, welche sich auch in „alten“ (wieder aufgewärmten) Lebensmitteln findet (z.B. Kartoffeln), ernährt Darmbakterien, die dann Buttersäure Produzieren. Die Buttersäure braucht es für die Integrität der Darmbarriere., also eigentlich etwas positives – nur nicht, wenn die falsche Darm-Besiedelung da ist. Insofern würde ich die Buttersäure (Butyrate) direkt als Supplement zuführen:
- Natrium Butyrate (BodyBio, 100 GMO-freie Kapseln) – keine für mich bedenklichen Inhaltsstoffe.
- Ggf. komplett unterschätzt. Nach Joe Cohen von Selfhacked eines der Supplemente die Ihn sehr weiter gebracht hat.
Anm.: Für weitere Links auf Probiotika, Glutamin, Magensäure verbessernde Mittel, bitte ich meinen Darm-Beitrag Teil 1 zu lesen. Es lohnt sich. Am Ende des Artikels gibt es dann zahlreiche iHerb-Links.
Zusätzlich macht natürlich eine Eliminationsdiät, mit der problematische Lebensmittel identifiziert und ausgeschlossen werden, in jedem Fall Sinn. Problematisch sind in der Regel Milch- und Weizenprodukte. Gluten, Soja, Kleie aller Art, alle möglichen und unmöglichen Zusatz- und Farbstoffe, Verdickungsmittel und übermäßig Zucker sind ebenfalls zu meiden.
Ach ja: Wenn Ihr bei iHerb etwas bestellen solltet, dann gebt bitte den 5% Rabatt-Code “HER2060“ an – und tut mir damit einen kleinen Gefallen.
Mein Fazit
Bei einem funktionellen Eisenmangel mit Anämie (ACD) sind Serum-Ferritin Werte in der Regel normal oder hoch, das Hb und andere Werte jedoch niedrig.
Generell gilt ein hohes Serum-Ferritin > 150 ng/ml (Frauen), > 200 ng/ml (Männer) [33] als ungünstig angesehen wird und mit zahlreichen entzündlichen und degenerativen Erkrankungen wie Krebs, ALS, Nierenleiden, Diabetes Typ II, Insulin-Resistenz, metabolischem Syndrom, Bluthochdruck, dem Herzinfarkt-Risiko, nicht-alkoholischer Fettleber, Leber-Fibrose, geringerer Lebenserwartung, diversen Eisenspeicher-Krankheiten und mehr korreliert [6]. Unschön.
Natürlich, und das ist für mich das Problem, helfen in dieser Situation kurzfristig Eisen-Supplemente und Infusionen. Diese sind jedoch bei normalen bzw. hohen Ferritin-Werten nicht angezeigt. Die Autoren von [29] schreiben zu oralen Eisen-Supplementen z.B.:
„… verschlimmert die Kolitis und ist mit oxidativem Stress verbunden, … Infiltration von Neutrophilen und Aktivierung des NF-kB-Signalwegs .., was die Expression von pro-inflammatorischen Zytokinen wie z. B. Interferon-γ (IFN-γ), Tumor-Nekrose-Faktor α (TNF-α) und induzierbare Stickstoffmonoxid-Synthase (iNOS) bewirkt …“
Und was macht das alles zusammen? Ich denke, dass es IL-6 hoch reguliert und damit das Problem, was beseitigt werden soll, noch verschärft!
So ist mit dem Hintergrund-Wissen dieses Artikels ggf. verständlich, warum, wie weiter oben schon geschrieben, Labore wie GanzImmun auf Basis von Studien darauf hinweisen, das Eisen-Mangelsymptome, wie diffuser Haarausfall, schon ab Serum-Ferritin Werten < 70 ng/ml auftreten können. 70 ng/ml sind „eigentlich“ gut gefüllte Eisenspeicher – aber nicht im Falle einer ACD., wo dies nicht verfügbar ist und auch nicht bei Akut-Phase Entzündungen, die z.B. eine leichte ICD überdecken können. Zu diesen Grenzfällen schreibe ich noch mehr in Teil 3.
Wichtig wäre mir noch einen Retinol- und/ oder Kupfer-Mangel auszuschließen, wobei dieser aus meiner Sicht eher mit ICD verknüpft ist. Zudem sind auch B12, B6 und Folat sowie anderes für die Bildung von Hämoglobin nötig. Wenn also eine Diagnose nicht gut abgrenzbar ist, macht es aus meiner Sicht Sinn immer auch andere Faktoren mit einzubeziehen bzw. zu überprüfen.
Was soll die „Lektion“ dieses Artikels sein?
Auf das ganze Bild zu schauen und nicht zu der vorgeblich ersten und einfachsten Lösung zu greifen. Ein Eisenmangel, egal ob funktional, real oder durch einen gestörten Eisen-Metabolismus hervorgerufen, hat Gründe. Diese Gründe sind fast nie, dass es in der Nahrung an Eisen fehlt. Einige der Gründe habe ich in diesem Artikel bereits aufgezählt.
Wenn jedoch die Serum-Ferritin Werte unter 18 ng/ml liegen, dann muss noch einmal genauer geschaut werden, speziell mit niedrigen Hb-Wert. Das ist dann Thema des dritten Teils dieser Serie, wobei ich hier schon einige der potentiellen Ursachen angeschnitten habe.
Links / Quellen
- [1] Iron homeostasis and oxidative stress: An intimate relationship, Dimitrios Galaris et al., Biochim Biophys Acta Mol Cell Res, 2019 Dec;1866(12):118535. doi: 10.1016/j.bbamcr.2019.118535. Epub 2019 Aug 22.
- [2] Iron metabolism in the reticuloendothelial system, Mitchell Knutson 1, Marianne Wessling-Resnick, Crit Rev Biochem Mol Biol, 2003;38(1):61-88. doi: 10.1080/713609210.
- [3] Effect of tocilizumab on haematological markers implicates interleukin-6 signalling in the anaemia of rheumatoid arthritis, John D Isaacs et al., Arthritis Res Ther, 2013;15(6):R204. doi: 10.1186/ar4397.
- [4] What is adverse effect of wireless local area network, using 2.45 GHz, on the reproductive system?, Birşen Bilgici et al., Int J Radiat Biol, 2018 Nov;94(11):1054-1061. doi: 10.1080/09553002.2018.1503430. Epub 2018 Sep 27.
- [5] Anemia of chronic disease, D A Sears, Med Clin North Am, 1992 May;76(3):567-79. doi: 10.1016/s0025-7125(16)30340-6.
- [6] Serum ferritin is an important inflammatory disease marker, as it is mainly a leakage product from damaged cells, Douglas B Kell 1, Etheresia Pretorius, Metallomics, 2014 Apr;6(4):748-73. doi: 10.1039/c3mt00347g.
- [7] Interpreting raised serum ferritin levels, Douglas B Kell 1, Etheresia Pretorius, BMJ 2015; 351 doi: https://doi.org/10.1136/bmj.h3692 (Published 03 August 2015)
- [8] Dietary iron absorption in pregnancy – a longitudinal study with repeated measurements of non-haeme iron absorption from whole diet, B Svanberg, B Arvidsson, E Björn-Rasmussen, L Hallberg, L Rossander, B Swolin, Acta Obstet Gynecol Scand Suppl, 1975;48:43-68. doi: 10.3109/00016347509156330.
- [9] Balancing Acts: Molecular Control of Mammalian Iron Metabolism, Matthias W Hentze et al., Cell, Volume 117, Issue 3, 30 April 2004, Pages 285-297
- [10] IL-6 mediates hypoferremia of inflammation by inducing the synthesis of the iron regulatory hormone hepcidin, Elizabeta Nemeth et al., J Clin Invest, 2004 May;113(9):1271-6. doi: 10.1172/JCI20945.
- [11] IL-6 as a keystone cytokine in health and disease, Christopher A Hunter, Simon A Jones, Nat Immunol, 2015 May;16(5):448-57. doi: 10.1038/ni.3153.
- [12] Leptin increases the expression of the iron regulatory hormone hepcidin in HuH7 human hepatoma cells, Bomee Chung et al., J Nutr, 2007 Nov;137(11):2366-70. doi: 10.1093/jn/137.11.2366.
- [13] Iron homeostasis in chronic inflammation, J Balla 1, V Jeney, Zs Varga, E Komódi, E Nagy, Gy Balla, Acta Physiol Hung, 2007 Mar;94(1-2):95-106. doi: 10.1556/APhysiol.94.2007.1-2.9.
- [14] The Role of Hepcidin and Iron Homeostasis in Atherosclerosis, Florian Wunderer et al., Pharmacol Res. 2020 Mar; 153: 104664., doi: 10.1016/j.phrs.2020.104664
- [15] Iron and the sex difference in heart disease risk., Sullivan JL., Lancet 1981;1(8233):1293–1294.
- [16] Associations of serum ferritin and transferrin % saturation with all-cause, cancer, and cardiovascular disease mortality: Third National Health and Nutrition Examination Survey follow-up study. , Kim KS, Son HG, Hong NS, Lee DH, J Prev Med Public Health. 2012 May; 45(3): 196–203., Published online 2012 May 31. doi: 10.3961/jpmph.2012.45.3.196
- [17] Intestinal DMT1 cotransporter is down-regulated by hepcidin via proteasome internalization and degradation, Carole Brasse-Lagnel et al., Gastroenterology, 2011 Apr;140(4):1261-1271.e1. doi: 10.1053/j.gastro.2010.12.037. Epub 2011 Jan 1.
- [18] Effects of IL-10 on iron metabolism in LPS-induced inflammatory mice via modulating hepcidin expression, P Huang et al., Eur Rev Med Pharmacol Sci, 2017 Aug;21(15):3469-3475.
- [19] Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-alpha, in vivo, V Mohamed-Ali et al., J Clin Endocrinol Metab, . 1997 Dec;82(12):4196-200. doi: 10.1210/jcem.82.12.4450.
- [20] Associations between serum hepcidin, ferritin and Hb concentrations and type 2 diabetes risks in a Han Chinese population, Xin Guo et al., Br J Nutr, 2013 Dec;110(12):2180-5. doi: 10.1017/S0007114513001827. Epub 2013 Jun 7.
- [21] Hepatic iron is the major determinant of serum ferritin in NAFLD patients, John D Ryan et al., Liver Int, 2018 Jan;38(1):164-173. doi: 10.1111/liv.13513. Epub 2017 Jul 29.
- [22] Correlation Between Serum Ferritin and Hepcidin Levels in Chronic Hepatitis C Patients, Maria Gill,Cureus. 2021 Aug; 13(8): e17484., Published online 2021 Aug 27. doi: 10.7759/cureus.17484
- [23] The serum hepcidin:ferritin ratio is a potential biomarker for cirrhosis, Terrence C H Tan et al., Liver Int, 2012 Oct;32(9):1391-9. doi: 10.1111/j.1478-3231.2012.02828.x. Epub 2012 Jun 7.
- [24] Serum and salivary ferritin and Hepcidin levels in patients with chronic periodontitis and type 2 diabetes mellitus, Lin-Na Guo et al., BMC Oral Health. 2018; 18: 63., Published online 2018 Apr 10. doi: 10.1186/s12903-018-0524-4
- [25] Serum hepcidin concentrations correlate with ferritin in patients with inflammatory bowel disease, Ingo Mecklenburg et al., Observational Study J Crohns Colitis, 2014 Nov;8(11):1392-7. doi: 10.1016/j.crohns.2014.04.008. Epub 2014 May 11.
- [26] Usefulness of the serum ferritin concentration in the detection of iron deficiency in a general hospital., J. Mazza et al., Can Med Assoc J. 1978 Oct 21; 119(8): 884–886., PMCID: PMC1819106
- [28] Revaluating serum ferritin as a marker of body iron stores in the traceability era, Simona Ferraro et al., Review Clin Chem Lab Med, 2012 Nov;50(11):1911-6. doi: 10.1515/cclm-2012-0129.
- [29] The Dark Side of Iron: The Relationship between Iron, Inflammation and Gut Microbiota in Selected Diseases Associated with Iron Deficiency Anaemia—A Narrative Review, Ida J. Malesza et al., Nutrients. 2022 Sep; 14(17): 3478., Published online 2022 Aug 24. doi: 10.3390/nu14173478
- [30] Curcumin: An Effective Inhibitor of Interleukin-6, Morteza Ghandadi 1, Amirhossein Sahebkar 2, Curr Pharm Des, 2017;23(6):921-931. doi: 10.2174/1381612822666161006151605.
- [31] Role of hepcidin in the pathophysiology and diagnosis of anemia, Guido D’Angelo et al., Blood Res. 2013 Mar; 48(1): 10–15., Published online 2013 Mar 25. doi: 10.5045/br.2013.48.1.10
- [32] Correlation between serum ferritin levels and liver iron concentration determined by MR imaging: impact of hematologic disease and inflammation, Allard W Olthof et al., Magn Reson Imaging, 2007 Feb;25(2):228-31. doi: 10.1016/j.mri.2006.09.019. Epub 2006 Nov 13.
- [33] Diagnosis and Management of Hemochromatosis: 2011 Practice Guideline by the American Association for the Study of Liver Diseases, Bruce R Bacon et al., Hepatology. 2011 Jul; 54(1): 328–343., doi: 10.1002/hep.24330
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.







Neuste Kommentare