Alpha-Liponsäure: Quecksilber-Chelator oder nicht? Einführung, Studien und Sichtweisen von A. Hall Cutler & C. Shade (Teil 1)

Alpha-Liponsäure – Quecksilber-Chelator oder nicht? Cutler oder Shade? Bildquelle: Pixabay
In diesem Artikel, und eigentlich dritten Teil zur Alpha-Liponsäure (ALA), möchte ich die Frage vertiefen ob ALA ein effektiver Quecksilber-Chelator ist, wie A. Hall Cutler es vertritt, oder ob ALA „nur“ über Nrf2 die antioxidativen- und Glutathion- (GSH) Systeme ‚hochreguliert‘ und die Mobilisation und Ausscheidung von Hg durch GSH vermittelt – wie Christopher Shade (-> Firma Quicksilver Scientific) es behauptet.
In ALA Teil 1 hatte ich schon thematisiert, dass die Alpha-Liponsäure neben Ihren diversen Rollen als potentes Pro- und Antioxidant und Nrf2 Stimulator (bzw. Induktor) auch ein potentieller Chelator von Quecksilber (und anderen Metallen) im Körper ist. Da ALA wasser- und fettlöslich (lipophil) ist, überwindet es die Blut-Hirn-Schranke (BHS) und kann innerhalb kurzer Zeit nach Verabreichung Zellmembranen durchdringen und hohe intrazelluläre Konzentrationen erreichen [17]. Neben Cutler [14] weist auch Sears [17] darauf hin, das die klinische Erfahrung zeigt, das ALA vorsichtig eingesetzt werden muss, da es besondere Risiken der Umverteilung von Metallen, u.a. Quecksilber, birgt. Was nun genau die Umverteilung auslöst – darüber schweigt sich Sears jedoch aus.
Das ALA Quecksilber ‚irgendwie‘ mobilisiert, daran besteht auf Basis der Studien von Gregus et al. (1992) [1][2][AC10][AC16], Leskova (1978) [3][AC7][AC21] und Grunert (1960) [24], auf denen Cutler sein Protokoll basierte, für mich kein Zweifel. Allerdings ist nicht final ‚im Menschen‘ (-> in vivo) geklärt, ob ALA auch dort ein direkter Hg-Chelator ist [16]. Genau deswegen geht es in diesem Artikel um folgende Themen:
- Alpha-Liponsäure: (Intrazellulärer) Hg-Chelator oder nicht – und warum ist das überhaupt eine Frage?
- Die Argumente von Shade & Cutler – in kurzer Kürze
- Zum Wissen und Nichtwissen über Quecksilber & seiner Ausscheidung
- Die Problematiken bei der Interpretation der Aussagen von Studien mit Quecksilber
- Ein schlechtes Beispiel: Aposhian et al. (2003) folgerten das ALA das Hg im Gehirn (von Ratten) nicht senke.
- Ein Überblick über die von Cutler angeführten ALA-Hg Studien von Gregus et al. (1992), Leskova (1979), Grunert (1960), Biewenga (1997) & Co.
- Ein Überblick auf die ALA-Hg Studien & Paper von Brown et al. (1970), Bjørklund et al. (2019), Chekmeneva et al. (2010) und Hossain (2020)
Dies ist nur der erste Teil dieser zweiten‘ Serie zu ALA – er soll in die Thematik einstimmen und die eigentliche Frage, ihre Relevanz & die Komplexität dieser Frage klar machen. In den nächsten Teilen versuche ich dann einige Studien im Detail vorzustellen, die Thematik zu vertiefen, sowie zusätzliche Perspektiven in Bezug auf die Interpretation der komplexen und lückenhaften Datenlage zu finden.
Wichtig: Dieser Artikel geht „in die Tiefe“. Um Ihn schreiben zu können habe ich viele Studien und Argumente im Detail durchgearbeitet, u.a. zu Quecksilber, Alpha-Liponsäure Chelatoren, Nrf2, Glutathion-Systemen, Membrantransportern, allgemeiner Biochemie, sicher 25 bis 30 ca. 1-1,5 Stunden lange Interviews von Shade und unzähliges anderes. Das waren viele, viele Wochen & Monate und unzählige Stunden. Was Ihr hier lest mag komplex erscheinen – es zusammenzutragen, es zu sortieren und die Lücken zu finden – war ungleich aufwändiger. Auch wer nicht von einer Hg-Belastung betroffen ist profitiert sicherlich vom Lesen dieses Artikels – weil es auch um viel „grundsätzliches“ geht.
Tipp: Hier alle Direktliks zu den Alpha-Liponsäure-Artikeln:
- Alpha-Liponsäure (ALA) Teil 1: Allgemeines, Antioxidanz (-> Nrf2, Redoxpartner), Metal-Chelator (ggf. Quecksilber), R- und S-Form, Bioverfügbarkeit, Interaktionen & Nebenwirkungen
- Alpha-Liponsäure Teil 2: Pharmakologische Halbwertzeiten von RS-ALA, (Na-) R-ALA, DHLA, Interaktionen mit Quecksilber (Hg) und das Cutler-Protokoll
- Cutler vs. Shade Teil 1: Alpha-Liponsäure: Quecksilber-Chelator oder nicht? Einführung, Studien und Sichtweisen von A. Hall Cutler & C. Shade
- Cutler vs. Shade Teil 2: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Die Zerlegung der wichtigsten Studien: Gregus, Leskova, Grunert, Chekmeneva, Hossain und Bjørklund
- Cutler vs. Shade Teil 3: Alpha-Liponsäure: Quecksilber-Chelator oder nicht?: Cutler vs. Shade – die Perspektive von R. Rust Lee und mein Fazit
Inhaltsverzeichnis für den Schnellzugriff
Alpha-Liponsäure: (Intrazellulärer) Hg-Chelator oder nicht?
Das Cutler-Protokoll zur Quecksilber-Ausleitung basiert a) auf der angeblichen Fähigkeit der Alpha-Liponsäure (ALA) Quecksilber (Hg) intrazellulär und im Gehirn zu mobilisieren, was die Standard-Chelatoren DMPS und DMSA nicht können [17] und b) auf der Annahme, das ALA das Hg auch effektiv binden kann, um es sicher aus dem Körper zu transportieren. Ein zentraler Punkt, der für mich noch kontrovers bzw. strittig war, ist die Frage ob ALA dies auch ‚in vivo‘, also im Menschen, macht. Gerade zu den letzten Aspekten gibt es verschiedene Ansichten:
- So steht A. Hall Cutler [14] auf dem Standpunkt, dass ALA ein direkter Hg-Chelator ist – also Hg-Ionen verschiedener Art direkt an sich bindet und relativ sicher (über Leber, Galle & den Stuhl) ausleiten kann – und dass die Bindung von Hg an ALA (und nicht GSH) der primäre Faktor für die Hg-Mobilisierung und Ausscheidung ist.
- C. Shade [u.a. 18] steht auf dem Standpunkt, das ALA primär ein potenter Nrf2-Induktor [22][23], Pro- und Antioxidanz ist und die Mobilisierung und Ausscheidung von Hg letztendlich über Glutathion (GSH) vermittelt sei. Shade verneint eine wie auch immer geartete Rolle von ALA als direkten Hg-Chelator.
- Aposhian et al. (2003) [13] verneint dann eine wie auch immer geartete positive Fähigkeit von allem: ALA, Glutathion und auch Vitamin C – in Gehirn und auch Organen (von Ratten) und argumentieren so gegen Shade und Cutler.
Nun mag sich die meine Frage wie ein abstraktes technisches Detail eines wissenschaftlichen Streites lesen – ist es aber nicht. Es ist eine zentrale Frage der Biochemie von bzw. zu ALA (bzw. seiner reduzierten Form DHLA, welche für die Bindung von Hg verantwortlich sein soll) und ein Streitpunkt zwischen Cutler & Shade [18-21]. Denn wenn ALA ein direkter Hg-Chelator ist, dann müsste dieses auch in regelmäßigen Abständen zugeführt werden – was meiner Interpretation nach zwingend für die grundsätzlichen Einnahmeregeln des Cutler-Protokoll sprechen würde.
… und warum ist das überhaupt eine Frage?
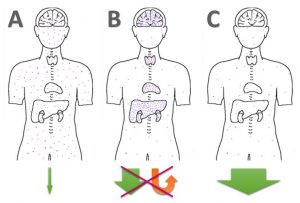
Die verschiedenen Formen der Quecksilber (Amalgam) und Schwermetall-Ausleitung: A) Gar nichts machen, B) Staub aufwirbeln und schön in Gehirn + Organe verteilen, C) effektiv binden & ausleiten. Bild: H.C. Fricke, basierend auf Lee & Cutler + Pixabay, Torso
Wenn Quecksilber im Körper mobilisiert, aber nicht effektiv gebunden und ausgeschieden wird – dann kommt es zu Umverteilung und Re-Vergiftung. ALA ist zweifelsfrei ein potenter Nrf2–Aktivator [25] und ‚kurbelt‘ damit die biochemische Entgiftung von Phase II an. Falls ALA, wie Chris Shade (Quicksilver Scientific) behauptet, kein effektiver Chelator für anorganisches Hg++ oder organisches Quecksilber (z.B. MeHg) sein sollte, sondern alle Effekte auf der durch ALA gesteigerten GSH-Produktion basieren sollte, dann würde das bedeuten, dass eine Schwermetall-Ausleitung nach dem Cutler-Protokoll:
- zwar ganz klar funktioniert – jedoch einiges an Potential ‚verschwendet‘, da
- die Einnahme von ALA alle 2-3 Stunden – rund um die Uhr – sehr belastend ist,
- die Einnahme von R-ALA (wie Shade es macht) ggf. deutlichst effektiver sein könnte,
- andere Dinge wie Bindemittel, zusätzliche Nrf2-Inducer und
- eine effektive Phase III Unterstützung (-> Membrantransporter ala MRP1/2, OATP) umso wichtiger wären.
Warum ist mir das alles so wichtig? Nur wenn die Rolle von ALA bei der potentiellen Hg-Ausscheidung klar ist – können auch die darauf basierenden Interventionen sinnvoll umgesetzt werden!
Die Argumente von Shade & Cutler – in kurzer Kürze
Shade argumentiert, ausweislich seiner Interviews [u.a. 18], dass der beobachtete Anstieg von anorganischem Quecksilber (Hg++) in der Galle (und final im Stuhl) das Ergebnis der Aktivierung von Nrf2 (Nuclear factor erythroid-related factor 2) durch Alpha-Liponsäure (ALA) ist, was in der Folge das Glutathion und auch die Expression der Glutathion-S-Transferasen (GST) erhöht. Nach Shade ist es das Glutathion, das für die Bewegung des Quecksilbers verantwortlich ist, nicht jedoch ALA (bzw. DHLA), da diese keine Chelatoren ‚an sich‘ sein. Insofern basiert Shades Detox-Konzept auf R-ALA, Glutathion (beide Liposomal) sowie einem proprietären Hg-Bindemittel für den Darm (mit Thiolen mikrofunktionalisierte Kieselsäure).
In Teil 2 der ALA-Serie hatte ich schon angeführt, dass nach Cutler das ALA/DHLA-Redoxpaar zwar das GSH in den Zellen erhöhe, weil es a) den oxidativen Stress senke und b) auch GSH regenerieren könne – GSH ‚alleine‘ jedoch kein Hg aus den Zellen entferne. ALA/DHLA erhöhe nach Cutler zwar dramatisch die Ausscheidung von GSH-Hg-Komplexen mit der Galle aus der Leber, wie auch Shade es sagt, aber GSH exportiere das Hg nicht zwangsweigerlich aus den Körper-, Organ- oder Gehirnzellen [AC18]:
“While mercury is excreted in the bile bound to glutathione, binding it to glutathione does not remove it from cells generally.”
Hingegen sei der Quecksilberionen-Dihydrolipoat-Komplex (Hg-DHLA) ladungsmäßig neutral oder an der Carboxylatgruppe, leicht protoniert und somit lipidlöslich. So könne der DHLA-Hg-Komplex leicht durch Zellmembranen hindurchgehen (Anm.: Mein Verständnis: Ohne aktiven enzymatischen Transporter). Auf diese Weise kann (nach Cutler) ALA (über das Zwischenprodukt DHLA, was vom Körper auf natürliche Weise aus ALA hergestellt wird) das Hg innerhalb der Zellen chelatieren und es aus den Zellen hinaus befördern. [26][AC6]
So stellt Cutler fest, das andere Antioxidantien nicht zu den tiefgreifenden und dauerhaften Reduzierungen der Symptome bei Hg-Toxizität wie bei ALA führen. Ich mag anmerken, das dies wohl auch andere Nrf2-Aktivatoren (u.a. Brokkoli-Extrakte, EGCG) nicht bewerkstelligen, die ebenfalls GSH & Co. erhöhen. Da die Veränderungen nach Beendigung der ALA-Therapie (im Sinne des Cutler-Protokolls) bestehen bleiben, müssen diese (nach Cutler) auf eine dauerhafte Veränderung der Körperchemie (-> weniger Schwermetalle) zurückzuführen sein [AC6]. Ich werte dieses als weiteres Argument von Cutler, dass DHLA auch ein Chelator und nicht nur ein Nrf2-Induktor ist – genauso wie die vielen Berichte von Nebenwirkungen wenn der 2-3, ggf 4 h – Intervall bei der Zufuhr von ALA nicht eingehalten wird.
Interessant ist, das Shade selber mal erwähnte, dass Nrf2 eine kurze Halbwertzeit (<30 Minuten) hat – die dadurch hochgeregelten antioxidativen Systeme jedoch bis zu 10 Tage (in Ratten) über wiederholende Nrf2-Induktionen ‚immer weiter‘ hochgeregelt werden können. Wenn nun die Hg-Mobilisierung und Ausleitung nur über Nrf2 & ‚mehr‘ GSH erfolgen würde, wie Shade es immer wiederholt, dann bräuchte es nur potente Nrf2-Induktoren (z.B. EGCG, Sulphoraphane) – aber nicht zwingend ALA. Wie im ersten Teil meiner ALA-Serie schon dargelegt macht ALA deutlich mehr als nur Nrf2 zu induzieren – was jedoch nichts ist, worauf sich Shade in seiner Detox-Argumentation beruft. Warum Shade nun unbedingt R-ALA nutzt bleibt so unklar, denn ALA ist bei weitem nicht der beste Nrf2-Inducer. Irgendwas an Shade seiner Geschichte ist also faul bzw. hat zumindest einen ‚Geschmack‘.
Zum Wissen und Nichtwissen über Quecksilber & seiner Ausscheidung

Normaler Zustand der Entgiftung: Hier werden Giftstoffe transformiert (Phase I) aber dadurch oft giftiger, (über Enzyme) transportfähig gemacht (Konjugation, Phase II) und mittels Transportproteinen (u.a. MRP2) aus den Zellen und Organen heraustransportiert (Phase III). Danach gelangen Sie über das Blut bei der Leber bzw. Niere wo es ebenfalls Transportproteine für den Eintritt in die Zelle gibt (u.a. OATP). Diese Organe schleusen dann die Giftstoffe in Urin (Niere) bzw. mittels Galle in den Dünndarm (Leber) – wieder mittels Transportproteinen (Phase III).
Die Wissens-, Sach- und Datenlage zu der Pharmakokinetik von Quecksilber ist komplex und auch im Jahr 2021 noch nicht vollends verstanden. Man weiß, dass sich die verschiedenen Arten von Quecksilber, anorganisches (Hg2+), organisches in einen verschiedenen Varianten (u.a. Methyl-Hg, MeHg) und metallisches (Hg0) unterschiedlich verhalten – also unterschiedlich aufgenommen, absorbiert und ausgeschieden werden. Allerdings sind viele Fragen und Aspekte der Quecksilber-Ausscheidung, der Rolle der Membrantransporter, des Glutathion und der Alpha-Liponsäure ungeklärt. [16] [HG1-6].
Es ist ja nicht so, das ein Hg-Ion einfach so aus der Zelle ‚herausmigriert‘. Für jeden Schritt der Ausscheidung braucht es irgend eine Verbindung des Hg-Ions mit etwas anderem – die kann ggf. spontan durch eine chemische Affinität zu einem Molekül geschehen (u.a. DMPS, DMSA, ggf. DHLA) oder durch einen aktiven Prozess (z.B. als Konjugat an Glutathion durch eine Transferase wie die GST). Dabei sind dann auch noch die verschiedenen Zell-Compartments (-> Teile, Bereiche) zu differenzieren (-> Zytosol, Mitochondrien, Endoplasmatisches Retikulum, etc.) – überall gibt es Barrieren, spezielle Transporter und Limitationen. Nebenstehend im Bild ist nur mal die ‚oberste Ebene‘ illustriert um die Komplexität der Giftstoff-Ausscheidung in ganz groben Zügen zu verdeutlichen:
- In der Zelle muss das Toxin (->hier das Hg-Ion) transportfähig gemacht werden: Es verbindet sich entweder spontan mit etwas Schwefelhaltigem (-> nicht-enzymatisch -> Komplex) oder es wird ‚aktiv‘ (-> Enzymatisch, z.B. mittels GST-P1) verbunden (-> ergibt ein Konjugat).
- Der Komplex ist ggf. Lipophil und kann eine Membrangrenze durch Diffusion überwinden (ggf. in Grenzen beim Hg-DHLA Komplex [AC6]) bzw. das Konjugat muss aus der Zelle heraus‚gepumpt‘ werden (-> aktiver Membrantransporter ala MRP1/2 unter Einsatz von ATP -> Energie).
- Irgendwie muss der Komplex bzw. das Konjugat ‚als ganzes‘ im Blut (-> was verstehen wir eigentlich darunter?) zu Niere oder Leber transportiert werden (-> Ausscheidungsorgane). Hoffentlich ist der Komplex oder das Konjugat da stabil… bzw. wird durch irgend einen Mechanismus wieder ‚eingefangen‘.
- Um in die Nieren- oder Leber-Zelle zu gelangen braucht es wieder Membrantransporter (z.B. OATP), da ja eine Zellmembran überwunden werden muss.
- In der Leber oder Niere gibt es dann weitere biochemische Prozesse, z.B. die Konjugierung von GSH an Hg oder andere Hg-Komplexe in der Leber [HG5] oder der Niere (z.B. GSH an DMPS-Hg).
- Um den Komplex oder das Konjugat aus der Leber- oder Nierenzelle in Urin oder Gallenkanäle zu transportieren braucht es wieder Membrantransporter (z.B. MRP2) oder aktive Gallensalzpumpen (BSEP).
- Im Darm (über die Gifte in der Galle) kann es zu einer Reabsorption in das Blut kommen – ggf. aber auch in der Blase (-> Urin).
- Überall geschehen enzymatische bzw. nicht-enzymatischen Reaktion mit anderen Stoffen (z.B. Selen), Molekülen, Substanzen oder Enzymen (-> welche Einflüsse hat das?).
Ich selber habe mit einigem Zeiteinsatz versucht zu verstehen, was man mit einiger Bestimmtheit meint zu wissen und was nicht, was man vermutet, etc. Allerdings bin ich kein Biochemiker und auch kein 3D-Stereo-Chemie-Profi und kann vieles nur in Ansätzen deuten. So schreibt denn eine Studie aus 2018 [HG6]:
„Es gibt nur wenige Daten, welche die Transportkinetik eines Quecksilberkonjugats an der Stelle eines spezifischen Transporters charakterisieren.“
So ist auch laut Studienlage in 2020 [16] immer noch nicht geklärt, ob DHLA (die reduzierte Form der Alpha-Liponsäure) nun ein (effektiver) Chelator für anorganisches Quecksilber (Hg2+) im Menschen ist – oder eben nicht. Die Hypothese das DHLA ein effektiver Hg2+-Chelator ist wurde spätestens von Gregus et al. (1992) [1] aufgeworfen und von Cutler (1999) populär gemacht. Dass die Gabe von ALA jedoch sehr unterschiedlich auf die Ausscheidung von Hg2+ und MeHg wirkt, machten die Versuche von Gregus et al. unbestreitbar klar [1]. Dieses kann jedoch viele Gründe haben, die nicht auf den ersten Blick klar sind, weil ALA/DHLA eine Vielzahl von verschiedenen Prozessen modulieren und selber als Redoxpaar zu vielen Prozessen in der Gestehung und dem Recycling von GSH beitragen.
Bei allem müssen wir immer Beweise, Theorien und Empirie – aber auch Fehlschlüsse auf Basis falsch interpretierter Empirie – unterscheiden. Optimal ist eine Theorie, welche durch ein geeigneten Versuch Empirisch (-> in der Praxis) ohne logische Lücken, also mit einem geeignetem Versuch und analytischen Methoden, bestätigt wurde. Allerdings ist es schwierig alle möglichen Zusammenhänge und biochemischen Vorgänge am Ort- und Zeitpunkt Ihres Geschehens zu beobachten und zu messen. Insofern müssen wir uns oft mit indirekten Messungen und Rückschlüssen – also neuen Theorien – zufrieden geben und diese nach Möglichkeit plausibilisieren und kritisch hinterfragen, um uns nicht selbst zu belügen. Das macht alles nicht einfacher.
Die Problematiken bei der Interpretation der Aussagen von (empirischen) Studien zu und mit Quecksilber
Cutler schreibt [AC8], dass die meisten Studien zu Hg-Intoxikationen bei Akutbelastungen gemacht wurden – aber nicht bei chronischen. Bei akuten Belastungen liegt das Hg meist noch im Körper und extrazellulär vor, so dass hier DMPS und DMSA in der Regel gut wirken. Mit der Zeit jedoch akkumuliert sich das Hg im Gehirn, den Zellen (Mitochondrien) und bestimmten Organen. Auch gibt es (über die Zeit) eine De-Methylierung des organischen Quecksilbers hin zu anorganischem Quecksilber. Insofern unterscheiden sich akute eine und chronische Belastung schon mal strukturell.
Weitere Probleme ergeben sich bei der Übertragbarkeit der Studien zwischen Ratten & Mäuse in Vergleich zum Menschen, da unsere Blut-Hirn-Schranke (BHS) wohl effektiver (-> weniger durchlässig ist) als die von Ratten und die meisten Tiere, u.a. auch Ratten, ihr eigenes Vitamin C bilden [AC16]. So gibt es Studien, welche die Versuchstiere mit anorganischen Quecksilber per Injektion oder Futter vergiften und andere wo diese Dämpfe einatmen. Anorganisches Hg (Hg2+) überquert jedoch nicht die BHS, so das auch hier wieder geschaut werden muss, mit welchem Hg ‚vergiftet‘ wird und welche Wege dieses nimmt. So wird z.B. organisches Methyl-Hg zu ca. 95% im Darm absorbiert – anorganisches jedoch nur zu ca. 10%. Wer das alles nicht beachtet bzw. beim Lesen der Studien antizipiert – zieht ggf. Fehlschlüsse.
Auch bei den Dosierungen und der zeitlichen Verabreichung der Chelatoren, meist bei Ratten und Mäusen, muss aufgepasst werden. Teils werden ‚absurd‘ hohe Dosen verwendet – oder sehr niedrige, welche kaum eine Wirkung haben sollten bzw. können. Wird z.B. ALA sehr früh bei einer akuten toxischen Belastung verabreicht, dann kann dieses durch Öffnung der BHS dafür sorgen, das Hg aus dem Körper in das Gehirn gelangt [AC10]. Cutler ist hier glasklar: Nichts kann das Hg aus dem Gehirn entfernen – alles was ein Chelator kann ist, das er:
„ermöglicht dem System, sich auf ein Gleichgewicht zwischen Blut und Gehirn zuzubewegen“
Meint: Nur wenn die Konzentration von Hg im (Rest-) Körper niedriger ist als im Gehirn, kann ein BHS-gängiger Chelator (-> nach Cutler ALA, nach B. Haley auch Irminix) das Hg aus dem Gehirn in den Körper ‚verschieben‘. Dann gibt es noch viele andere Probleme mit Studien bzw. der grundsätzlichen Konzeption der Studien wie:
- unzulängliche analytische Verfahren,
- oft keine Unterscheidung der verschiedenen Arten des gemessenem Hg (zumindest anorganisch, organisch),
- unvollständige Angaben in Bezug auf die verwendeten Vitamine & Chelatoren sowie
- teils verwirrende, fehlende bzw. wechselnde Angaben in Bezug auf die Dosierungen, Mess- und Vergleichswerte.
Wer dann bestimmte Unterschiede und Dynamiken der verschiedenen Ausscheidungswege, Organe und Arten von Quecksilber nicht kennt – der zieht schnell falsche Schlüsse. Ich denke, das bei den Aussagen in diesem Abschnitt auch Shade (Quicksilver Scientific) und B. Haley (Irminix, NMBI) mitgehen.
Ein schlechtes Beispiel: Aposhian et al. (2003) folgerten das ALA das Hg im Gehirn (von Ratten) nicht senke.
Als Quelle oder Argument dafür, das ALA, Gluthation und Vitamin C nicht hilfreich wären um Hg aus Gehirn und Niere zu mobilisieren bzw. es dort zu senken wird oft Aposhian et al. (2003) [13] zitiert. In dieser Studie wurde GSH, Vitamin C und / oder Liponsäure allein oder in Kombination mit DMPS oder DMSA jungen Ratten verabreicht, die 7 Tage mit elementarem Quecksilber durch die Atemluft exponiert bzw. vergiftet wurden. In der Zusammenfassung ließt man dann (deepl.com):
„Ergebnisse: Keine dieser Behandlungen reduzierte den Quecksilbergehalt des Gehirns. Obwohl DMPS oder DMSA bei der Reduzierung der Quecksilberkonzentration in den Nieren wirksam waren, waren GSH, Vitamin C, Liponsäure allein oder in Kombination nicht wirksam.“
Wer nun in die Arbeit schaut wird folgendes sehen [13]:
- DMSA 1 mol/kg, per Magensonde (182.2 mg/mol = 182.2 mg/Kg) aber auch intraperitoneal (als Injektion in die Bauchhöle),
- DMPS 1 mol/kg, subkutan verabreicht (188,27 mg/mol = 188,27 mg/kg) aber auch intraperitoneal,
- Na-Ascorbat, 71 mg/kg, intraperitoneal;
- GSH, 225 mg/kg, intraperitoneal.
- Alpha-Liponsäure (unbekannte Form!) mit (nur) 10 mg/kg. per Magensonde, wobei im Text auch mal ‚reduzierte Liponsäure‘ (DHLA) angegeben wird – was denn nun?.
Was fällt auf? a) Extrem hohe Dosen an DMPS/DMSA – im Bereich von 10% des LD50 (~ 13 g DMPS für einen 75 Kg schweren Menschen), b) im Vergleich Minidosen an Vitamin C und ALA, c) verschiedene Einheiten, d) verschiedene und wechselnde Verabreichungsformen & Bedingungen die nur den Bildunterschriften zu entnehmen sind, e) unbekannte Form von ALA. Cutler, welchem Aposhian auch auf Nachfrage nicht die verwendete Form von ALA nennen konnte, urteilt zur Studie noch härter u.a. [AC22]:
„ALA, GSH, Vitamin C, wurden unter Bedingungen verwendet, wo niemand bei klarem Verstand eine Wirkung oder einen Effekt erwarten würde – und tatsächlich wurde keiner gefunden.“
Wer PubMed nach Aposhian durchsucht, der wird sehr viele Veröffentlichungen zu Schwermetallen von ihm finden. Insofern verwundert dieses ’schlampige‘ Studiendesign doch sehr. Cutler weiter (deepl.com):
„Ich habe eine Hypothese, warum LA anscheinend nicht sehr effektiv war: wenn die Gesamtkörperbelastung mit Quecksilber zu Beginn hoch war, verteilt ALA es einfach im ganzen Körper und versucht, ein Gleichgewicht zu erreichen, so dass man, um eine signifikant niedrigere Menge zu sehen, länger chelatisieren müsste„

Alpha-Liponsäure oder Insulin verringerten weder das anorganische Quecksilber in der Niere noch verstärkten sie die DMSA-Wirkung. DMSA, 1,0 mmol/kg Körpergewicht wurde mit einer Magensonde verabreicht; den Tieren wurden 7 Tage lang zweimal täglich jeweils 1,5 Einheiten Humaninsulin IP injiziert; reduzierte Liponsäure wurde in Kochsalzlösung aufgelöst und 7 Tage lang zweimal täglich 10 mg/kg Körpergewicht mit einer Magensonde verabreicht. Ansonsten Durchführung wie bei Abb. 1. Quelle: [1], Abb. 8

Anorganisches Quecksilber (Hg0) im Gehirn wurde durch Liponsäure, Insulin, DMSA oder Kombinationen davon nicht verringert. DMPS, 1 mmol/kg, wurde subkutan verabreicht; DMSA, 1,0 mmol/kg Körpergewicht wurde mit einer Magensonde verabreicht; den Tieren wurden 7 Tage lang zweimal täglich jeweils 1,5 Einheiten Humaninsulin IP injiziert; reduzierte Liponsäure wurde in Kochsalzlösung aufgelöst und 7 Tage lang zweimal täglich 10 mg/kg Körpergewicht mit einer Magensonde verabreicht. Quelle: [1], Abb. 7
Komplett verwirrend ist dann die Angabe unter Bild 7, das (deepl.com):
„reduzierte Liponsäure wurde in Kochsalzlösung aufgelöst und 7 Tage lang zweimal täglich 10 mg/kg Körpergewicht mit einer Magensonde verabreicht“
Wurde da DHLA anstatt ALA gegeben? Und wenn ja welches? R-DHLA ist ja zumindest heutzutage erhältlich, wobei mir unklar ist, was es in einer Kochsalzlösung macht oder wie Stabil es da ist.
Abschließend sollte klar geworden sein, das die Studie von Aposhian aufzeigt, das auch Megadosen von DMPS und DMSA in der Niere wirken – aber nicht im Gehirn. Konzentrationen von Hg im Blut wurden nicht gemessen – jedoch waren Sie in der Niere um ca. Faktor 50 höher als im Gehirn, was auch folgerichtig ist, da die Niere das primäre Akkumulationsorgan für Hg2+ ist und DMSA & DMPS das Hg über die Niere entgiften. Da die Hg-Vergiftung aktuell und die DMPS/DMSA-Dosis 40-120 mal höher als für den Menschen ’normal ist‘, war – ist fraglich, welche Lehren hier zu ziehen sind. Im Vergleich war die ALA-Dosis aus menschlicher Sicht ’normal-niedrig‘ und wurde auch nur 2 mal am Tag verabreicht.
Ggf. scheint verwunderlich, dass die Gabe von ALA, bei einzelner Anwendung, die Hg-Konzentration im Gehirn und den Nieren weder gesenkt noch (durch Mobilisierung) erhöht hatte. Hier ist aus meiner Sicht jedoch die totale Menge der Hg-Belastung zu bedenken. Wenn selbst die 18-fache Bruttomenge an DMSA (im Vergleich zu ALA), einem potenten synthetischen Chelator im Bereich der toxischen Höchstdosis, die Belastung der Niere nur um ca. 50% senken kann – dann verwundert es mich nicht, wenn der ‚physiologische Chelator‘ ALA in dem sehr kurzen Zeitraum von 7 Tagen, keine relevante Änderung der Hg-Belastung herbeigeführt hat. Wer denn auch mit ALA nach Cutler cheliert bzw. ausleitet, der tut dieses in der Regel über Jahre und nicht wenige Tage – und fängt auch frühstens 3 Monate nach Ende der Hg-Exposition damit an, nicht schon nach 7 Tagen.
Nach Cutler [14, Seite 206/7], kann denn auch bei einem Menschen mit 20 mg ALA pro Kg/Tag die Ausscheidung von Hg über den Stuhl nur um Faktor 2 gesteigert werden, mit 182 mg/Kg/Tag DMSA aber um Faktor 3,3 (Urin) und mit 188 mg/kg/Tag und DMPS (per Injektion) um Faktor 16,5 (Urin). Aus weiteren Ergebnissen der Studie von Aposhian wird denn auch der große Unterschied zwischen DMPS (per Injektion) & DMSA (Oral, Magensonde) klar.
Ach ja: Die verwendeten DMPS / DMSA Dosierungen dürften für einen Menschen in mehrfacher Hinsicht tödlich sein – falls irgendwer denken sollte das er damit schneller sein Quecksilber „los wird“.
Ein Überblick über die von Cutler angeführten ALA-Hg Studien von Gregus et al. (1992), Leskova (1979), Grunert (1960), Biewenga (1997) & Co.
Cutler gibt vier Studien an, die für Ihn, neben eigenen Erfahrungen, diversen Rückmeldungen und Messungen im Urin, die Grundlage für sein Protokoll und die Pharmakokinetik waren [AC9]: Gregus et al. (1992) [1][2], Leskova (1979) [3], Grunert (1960) [24], Biewenga (1997) [10]. Zur besseren Übersicht hier die übersetzten Studien-Titel:
- Gregus: Wirkung von Liponsäure auf die biliäre Ausscheidung von Glutathion und Metallen. (Ratten) [1]
- H.C.: Die Primäre Studie die Cutler anführt und welche die meisten empirischen bzw. experimentellen Daten in Bezug auf die potentielle Pharmakokinetik von ALA in Bezug auf Hg2+ und MeHg liefert.
- Leskova: Schützende Wirkung von Liponsäureamid bei experimentellem Mercurialismus (Weiße Ratten) [3]
- H.C.: Nur in russisch verfügbar, nicht so detailliert wie Gregus – aber unterstützt nach Cutler die von Gregus gemessenen Werte der Hg-Ausscheidung in Bezug auf die Dosierung von ALA.
- Grunert: Die Wirkung von DL-alpha-Liponsäure auf Schwermetallintoxikation bei Mäusen und Hunden [24]
- H.C.: Gibt Hinweise auf einige zusätzliche zeitliche Effekte bei der Zufuhr von ALA, was nach Cutler ein wichtiger Beitrag dieser Studie ist.
- Biewenga: Die Pharmakologie des Antioxidans Liponsäure [10]
- H.C.: Selbsterklärend 😉
Meint: 3 Studien, welche die Wirkung von RS-ALA an Ratten, Mäusen und Hunden untersucht haben – in der Praxis – also (empirische) Primärquellen, keine Hypothesen. Dazu noch eine recht umfassende Abhandlung über ALA (Biewenga, 17 Seiten). Es gibt noch weitere Studien die Cutler angibt und welche die Wirkung von ALA auf Hg belegen:
- Anuradha (1999): Protektive Rolle von DL-alpha-Liponsäure gegen Quecksilber-induzierte neurale Lipidperoxidation [15]
- Cutler: „Obige Arbeit zeigt die Wirksamkeit von LA bei Quecksilberproblemen im Gehirn“ [AC19]
- Domanska-Janik (1987): Wirkung von Quecksilber auf Kaninchen Myelin CNP-ase in vitro [12]
- Cutler: „Obige Arbeit zeigt, dass LA tatsächlich das eingelagerte Quecksilber entfernen und das Problem beheben kann.“ [AC19]
Cutler schreibt zu den ersten 4 Studien [AC9], das sein Protokoll auf diesen sowie, auf vielen menschliche Erfahrungen und zuverlässigen Urintests (die schwer zu arrangieren sind) basiert. Weitere Studien behandeln auch DMSA und DMPS, u.a. wie viel Hg durch diese ausgeleitet bzw. bewegt wird. Zusammenfassend schreibt Cutler dann [AC9] das ALA (deepl.com):
- mehr Quecksilber als DMSA oder DMPS entfernt.
- es aus mehr Teilen des Körpers entfernt sowie
- das diese Schlussfolgerung völlig empirisch ist – nicht theoretisch.
Cutler äußert sich in anderen Beiträgen bei Onibasu auch noch dediziert zu den Studien von Gregus und Leskova – was ich jedoch weiter unten im Text genauer betrachten werde. Schon hier möchte ich anmerken, das Shade in Bezug auf die Empirie von ALA Cutler nicht widerspricht – jedoch andere Schlüsse auf Basis der Studien zieht.
Christopher Shade von Quicksilver Scientific [18] behaupten nun, das die Studien von Gregus et al. [1], Leskova [3], Grunert [24] und die Veröffentlichung von Biewenga [10] nicht belegen würden, das ALA als Dihydroliponsäure (DHLA) Hg-Ionen direkt chelieren und ausleiten würde. Shade bestätigt jedoch, das die Verabreichung von ALA zu einer höheren Ausscheidung von Hg führe, dies aber aus seiner Sicht kein Beweis für die Chelationsfähigkeit von ALA bzw. DHLA in Bezug auf Hg-Ionen sei.
Aus Sicht von Shade ist die (R-) Alpha-Liponsäure verantwortlich für die (starke) Induktion von Nrf2, welche in Folge die antioxidativen (Phase II & III) System hochreguliere, u.a. die Glutathion-Synthese und die Glutathion-S-Transferasen, was dann die Mobilisation von Hg aus den Zellen und die Ausscheidung über die Leber und in den Dünndarm bewirke. Letztendlich werde nach Shade Hg2+ und MeHg über GSH-Komplexe bzw. Konjugate in der Galle in den Dünndarm ausgeschieden – nicht aber als DHLA-Hg-Komplexe. Ob (R-)ALA jedoch in solch kurzer Zeit (wie von Gregus aufgezeigt) über Nrf2 die GSH-Systeme ‚hochregulieren‘ kann – genau das klärt Shade nicht. Das was ich an Nrf2/ALA Studien in Bezug auf die hochregulierung der antioxidativen Systeme kenne, u.a. auch in Bezug auf die zeitlichen Komponenten, reicht aus meiner Sicht nicht aus um das zu erklären was Gregus gemessen hat.
Ein Blick auf die ALA-Hg Studien & Paper von Brown et al. (1970), Bjørklund et al. (2019), Chekmeneva et al. (2010) und Hossain (2020)
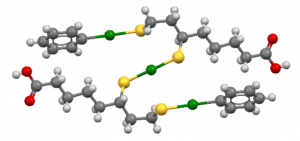
Die (theoretisch-berechnete) Struktur des Komplexes, der aus zwei DHLA-Molekülen, einem Hg2+-Ion und zwei Phenyl-Hg-Gruppen besteht. Quecksilber in grün, Schwefel in gelb und Sauerstoff in rot. Quelle: A Review on Coordination Properties of
Thiol-Containing Chelating Agents Towards Mercury, Cadmium, and Lead, Bjorklund et al., Lizenz: CC BY SA 4.0 Quelle: [4]
- Brown: Die Reaktionen von 1,3-Dimercaptopropan, Liponsäure und Dihydroliponsäure mit Metall-Ionen [11]
- H.C.: Untersucht spezifisch die Chelatorenfähigkeit von ALA/DHLA in Bezug auf verschiedenste Schwermetalle, u.a. Hg2+
- Hossain: Regulatorische Effekte von Dihydroliponsäure gegen anorganisches Quecksilber-vermittelte Zytotoxizität und intrinsische Apoptose in PC12-Zellen
- H.C.: Sehr detaillierte Studie zu den Auswirkungen Hg/DHLA auf verschiedenste Enzyme und Expressionen von u.a. akt, p-akt, mTOR, GR,NFkB, ERK1, Nrf2, HO-1, gespaltene Caspase 3 und Cytochrom c – aber auch Überlegungen zu der potentiellen Chelatorenfähigkeit von DHLA.
- Chekmeneva: Komplexierung von Hg2+ mit α-Liponsäure und Dihydroliponsäure: Untersuchung mittels Differentialpulsvoltammetrie an rotierender Au-Scheibenelektrode und ESI-MS [6]
Dann gibt es noch zwei Literatur-Reviews von Bjørklund et al. (2019) [4][5], welche ebenfalls eine mögliche Chelatorenfähigkeit von ALA thematisieren, sich dabei aber auf Chekmeneva [6] beziehen und weitere Überlegungen beisteuern. Auch hier zur besseren Übersicht die übersetzten Studien-Titel:
- Bjørklund: Einblicke in Alpha-Liponsäure und Dihydroliponsäure als vielversprechende Fänger von oxidativem Stress und mögliche Chelatoren in der Quecksilber-Toxikologie [4]
- Bjørklund: Ein Überblick über die Koordinationseigenschaften von Thiol-haltigen Chelatbildnern gegenüber Quecksilber, Cadmium und Blei [5]
Mit Verweis auf Patrick et al. [8] schreiben Bjørklund et al. [4] jedoch auch, das, was Shade immer wieder in Bezug auf ALA thematisiert:
„Das Potenzial von α-LA, der Hg-Toxizität entgegenzuwirken, ist grundlegend mit der Fähigkeit der Zellen verbunden, ihre stressreaktive Maschinerie zu aktivieren.“
Wichtig zu wissen: Keiner hat je in-vivo, also im Menschen, bestimmt (-> gemessen) ob sich dort R-ALA-Hg-Komplexe bilden und ob diese dann auch stabil genug sind um aus den Zellen (über Membran-Transporter), das Blut, die Leber, den Dünndarm und final in den Kot zu gelangen. Bei Cystein-, Thiol-, Schwefel- oder Glutathion-Hg-Komplexen ist dies aller Voraussicht nach der ’natürliche‘ Weg – welchen auch Cutler zubilligt und auf welchem Shade, mit Fokus auf GSH, sein Konzept aufgebaut hat. In wie weit eine direkte (potentielle) in-vivo Chelatorenfähigkeit von ALA/DHLA, die es wohl klar (in der Petrischale) gibt, bei dem gesamten Prozess der Hg-Ausscheidung im Menschen eine Rolle spielt, und insbesondere die Ausscheidung deutlich beschleunigt und wie – ist also noch zu diskutieren.
Mein Fazit
Um diesen Artikel zu schreiben habe ich mich ca. 2 Jahre mit der Thematik der Quecksilber-Ausleitung, dem Cutler-Protokoll, dem Shade-Protokoll, Alpha-Liponsäure, den üblichen Chelatoren, Nrf2 und vielem anderen Dingen beschäftigt. Ausstehend ist noch eine Tiefbohrung in Bezug auf Glutathion.
Die gestellte Frage ist für die meisten Menschen sicherlich sehr abstrakt – diese wollen nicht wissen wie etwas funktioniert – sondern nur, ob es funktioniert und was zu tun ist. Leider ist das alles nicht so einfach. Wer Cutler, Shade & Co. fragt ob Ihre Ansätze funktionieren wird immer ein Ja hören – wobei jeder dann erklärt, warum sein Ansatz funktioniert un der andere eben nicht bzw. der andere irgendwelche Probleme oder Unzulänglichkeiten hat. In diesem Teil sollte klar geworden sein, das Shade zwar Cutler kritisiert – aber selber keine schlüssigen Beweise für seinen Ansatz liefert um das was Gregus & Co. gemessen haben zu plausibilisieren. Um hier noch etwas mehr Klarheit zu gewinnen, werde ich im zweiten Teil in die Gregus-Studie ‚tiefbohren‘ – der Kerstudie auf die sich Cutler für seine Erklärungen beruft.
Links / Quellen
- [1] Effect of lipoic acid on biliary excretion of glutathione and metals., Gregus Z, Stein AF, Varga F, Klaassen CD, Department of Pharmacology, University Medical School of Pecs, Hungary., Toxicol Appl Pharmacol 1992 May;114(1):88-96, doi: 10.1016/0041-008x(92)90100-7
- [2] Analysis and explanation of the Lipoic Acid work by Gregus, Robert Cartland, 19 Feb 2003
- [3] Zashchitnyi effekt amida lipoevoi kisloty pri eksperimental’nom merkurializme. [Protective effect of lipoic acid amide in experimental mercurialism], Leskova GE, Gig Tr Prof Zabol 1979 Jun;(6):27-30 (Teiltext)
- [4] Insights on alpha lipoic and dihydrolipoic acids as promising scavengers of oxidative stress and possible chelators in mercury toxicology, Geir Bjørklunda et al., Volume 195, June 2019, Pages 111-119, Journal of Inorganic Biochemistry, doi: 10.1016/j.jinorgbio.2019.03.019
- [5] A Review on Coordination Properties of Thiol-Containing Chelating Agents Towards Mercury, Cadmium, and Lead, Geir Bjørklund et al., Molekules, Molecules. 2019 Sep; 24(18): 3247., Published online 2019 Sep 6. doi: 10.3390/molecules24183247
- [6] Complexation of Hg2+ with α-lipoic and dihydrolipoic acids: study by differential pulse voltammetry on rotating Au-disk electrode and ESI-MS, E. Chekmeneva, J.M. Díaz-Cruz, C. Ariño, M. Esteban, Electroanalysis 22 (2010) 177–184., doi: 10.1002/elan.200900299
- [7] The role of thiols, dithiols, nutritional factors and interacting ligands in the toxicology of mercury, James P K Rooney, Toxicology, 2007 May 20;234(3):145-56., doi: 10.1016/j.tox.2007.02.016. Epub 2007 Mar 1.
- [8] Mercury toxicity and antioxidants: Part 1: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity, Lyn Patrick, Altern Med Rev, 2002 Dec;7(6):456-71. (PDF)
- [9] Lipoic Acid: The Antioxidant Chameleon, J. R. Pfaffly, Biosciences Department,The University of Iowa, Iowa City, IA 52242, February 22, 2001
- [10] The pharmacology of the antioxidant lipoic acid, Gerreke Ph.Biewenga et al., General Pharmacology: The Vascular System, Volume 29, Issue 3, September 1997, Pages 315-331, doi: 10.1016/S0306-3623(96)00474-0
- [11] The reactions of 1, 3-dimercaptopropane, lipoic acid, and dihydrolipoic acid with metal ions, Phyllis R.Brown, John O.Edwards, Journal of Inorganic and Nuclear Chemistry, Volume 32, Issue 8, August 1970, Pages 2671-2675, doi: 10.1016/0022-1902(70)80316-5
- [12] Effect of mercury on rabbit myelin CNP-ase in vitro, K Domanska-Janik, J M Bourre, Neurotoxicology, Spring 1987;8(1):23-32.
- [13] Vitamin C, Glutathione, Or Lipoic Acid Did Not Decrease Brain Or Kidney Mercury In Rats Exposed To Mercury Vapor, H. Vasken Aposhian, Daniel L. Morgan, H. L. Sam Queen, Richard M. Maiorino & Mary M. Aposhianm, Journal Journal of Toxicology: Clinical Toxicology Volume 41, 2003 – Issue 4, Pages 339-347, Published online: 06 Feb 2003, doi: 10.1081/CLT-120022000 (Kritik von Cutler: Nr. 1, Nr. 2)
- [14] Amalgam Illness: Diagnosis & Treatment: What You Can Do to Get Better, How Your Doctor Can Help You, Andrew Hall, Ph.D. Cutler , 1. Juni 1999
- [15] Protective role of DL-alpha-lipoic acid against mercury-induced neural lipid peroxidation, B Anuradha 1, P Varalakshmi, Pharmacol Res, 1999 Jan;39(1):67-80. doi: 10.1006/phrs.1998.0408.
- [16] Regulatory effects of dihydrolipoic acid against inorganic mercury-mediated cytotoxicity and intrinsic apoptosis in PC12 cells, Kaniz Fatima Binte Hossain, ,Ecotoxicol Environ Saf, 2020 Apr 1;192:110238. doi: 10.1016/j.ecoenv.2020.110238. Epub 2020 Feb 6.
- [17] Chelation: Harnessing and Enhancing Heavy Metal Detoxification—A Review, Margaret E. Sears, ScientificWorldJournal. 2013; 2013: 219840., Published online 2013 Apr 18. doi: 10.1155/2013/219840
- [18] Dr. Christopher Shade Interview on Heavy Metal Detoxification for Autism, Becky Davila, 05.12.2019
- [19] The Chelation Wars, Episode One, Rebecca Lee, 21.12.2019
- [20] About the Chris Shade Interview, Rebecca Lee, 17.2.2020
- [21] Episode Three of „The Chelation Wars“. What exactly is Lipoic Acid, Rebecca Lee, 5.4.2020
- [22] Protective effect of lipoic acid against oxidative stress is mediated by Keap1/Nrf2-dependent heme oxygenase-1 induction in the RGC-5 cellline, Yoshiki Koriyama, Brain Res, 2013 Mar 7;1499:145-57., doi: 10.1016/j.brainres.2012.12.041. Epub 2013 Jan 4.
- [23] Sulforaphane and α-Lipoic Acid Upregulate the Expression of the π Class of Glutathione S-Transferase through c-Jun and Nrf2 Activation, Chong-Kuei Lii, et al., The Journal of Nutrition, Volume 140, Issue 5, May 2010, Pages 885–892, https://doi.org/10.3945/jn.110.1214
- [24] The effect of DL-alpha-lipoic acid on heavy-metal intoxication in mice and dogs, R R GRUNERT, Arch Biochem Biophys, 1960 Feb;86:190-4. doi: 10.1016/0003-9861(60)90402-1.
- [25] Lipoic Acid: Energy Production, Antioxidant Activity and Health Effects (Oxidative Stress and Disease), Mulchand S. Patel, Lester Packer, CRC Press, Year: 2008, ISBN: 1420045377
- [26] Direct and indirect antioxidant properties of α-lipoic acid and therapeutic potential, Luc Rochett et al., Mol Nutr Food Res, 2013 Jan;57(1):114-25., doi: 10.1002/mnfr.201200608.
Quellen / Referenzen speziell zur Hg-Pharmakokinetik & Ausscheidung sowie Anmerkungen von Cutler mit relevanten Auszügen
Der Rest dieses Beitrages ist nur für eingeloggte Freunde des Blogs einsehbar. Bitte logge Dich ein, oder schaue unter dem Menüpunkt 'Freunde des Blogs' für weitere Informationen wenn ein ernsthaftes Interesse besteht hier weiter zu lesen.










Neuste Kommentare